Đáp án đề thi chọn học sinh giỏi Hóa học 12 - Năm học 2015-2016 - Sở GD & ĐT Vĩnh Phúc
Bạn đang xem tài liệu "Đáp án đề thi chọn học sinh giỏi Hóa học 12 - Năm học 2015-2016 - Sở GD & ĐT Vĩnh Phúc", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
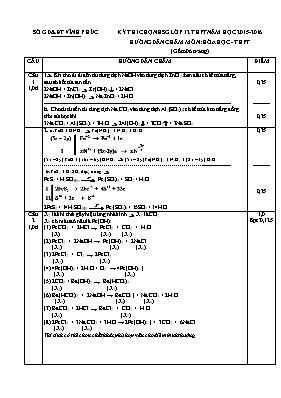
SỞ GD&ĐT VĨNH PHÚC KỲ THI CHỌN HSG LỚP 12 THPT NĂM HỌC 2015-2016 HƯỚNG DẪN CHẤM MÔN: HÓA HỌC - THPT (Gồm 06 trang) CÂU HƯỚNG DẪN CHẤM ĐIỂM Câu 1 1,0đ 1.a. Khi cho từ từ đến dư dung dịch NaOH vào dung dịch ZnCl2: ban đầu có kết tủa trắng, sau đó kết tủa tan dần. 2NaOH + ZnCl2 Zn(OH)2 + 2NaCl 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O ----------------------------------------------------------------------------------------------------------- b. Cho từ từ đến dư dung dịch Na2CO3 vào dung dịch Al2(SO4)3: có kết tủa keo trắng đồng thời sủi bọt khí 3Na2CO3 + Al2(SO4)3 + 3H2O 2Al(OH)3 + 3CO2 + 3Na2SO4 0,25 ---------- 0,25 2. a. FeO + HNO3 Fe(NO3)3 + NxOy + H2O (5x – 2y) FeO + (16x – 6y) HNO3 (5x – 2y) Fe(NO3)3 + NxOy + (8x – 3y) H2O ------------------------------------------------------------------------------------------------------------ b. FeS2 + H2SO4 đặc, nóng FeS2 + H2SO4đặc Fe2(SO4)3 + SO2 + H2O 2FeS2 + 14H2SO4đặc Fe2(SO4)3 + 15SO2 + 14H2O 0,25 ---------- 0,25 Câu 2 1,0đ X2 là khí thải gây hiệu ứng nhà kính X2 là CO2. X6 có màu đỏ nâu là Fe(OH)3. (1) FeCO3 + 2HCl ® FeCl2 + CO2 + H2O (X) (X1) (X2) (2) FeCl2 + 2NaOH ® Fe(OH)2 + 2NaCl (X1) (X3) (X4) (3) 2FeCl2 + Cl2 ® 2FeCl3 (X1) (X5) (4) 4Fe(OH)2 + 2H2O + O2 ® 4Fe(OH)3 ↓ (X3) (X6) (5) 2CO2 + Ba(OH)2 ® Ba(HCO3)2 (X2) (X7) (6) Ba(HCO3)2 + 2NaOH ® BaCO3 ↓ + Na2CO3 + 2H2O (X7) (X8) (X9) (7) BaCO3 + 2HCl ® BaCl2 + CO2 + H2O (X8) (X2) (8) 2FeCl3 + 3Na2CO3 + 3H2O ® 2Fe(OH)3 ↓ + 3CO2 + 6NaCl (X5) (X9) Thí sinh có thể chọn chất khác phù hợp vẫn cho điểm bình thường 1,0 8pt*0,125 Câu 3 1,5đ Câu 4 1,0đ 1.a. 4-hiđroxi-3-metoxibenzandehit 4-metoxibenzanđehit p-isopropylbenzanđehit ----------------------------------------------------------------------------------------------- b. Chất 4-hiđroxi-3-metoxibenzandehit có nhiệt độ sôi cao nhất 0,5 -------- 0,25 2. a. Công thức cấu tạo: A1: CH3 – CO – CH3 A2: CH3 – COOH A3: A: ----------------------------------------------------------------------------------------------- b. Viết đúng 2 đồng phân hình học 0,5 0,25 Đặt số mol của Al, Fe, Cu trong 23,4 gam hỗn hợp G lần lượt là x, y, z mG = 27x + 56y + 64z = 23,4 (1) * G + H2SO4 đặc nóng dư: x 3x (mol) y 3y (mol) z 2z (mol) 1,35 0,675 (mol) ne = 3x + 3y + 2z = 1,35 (2) * G + H2SO4 loãng: Cu không phản ứng. x 3x (mol) y 2y (mol) H2 + CuO Cu + H2O Khối lượng chất rắn giảm là khối lượng O trong CuO phản ứng H2SO4 dư dư = 0,4 (mol) dư = 0,8 (mol) Giải hệ phương trình (1), (2) và (3) được ---------------------------------------------------------------------------------------------- * Bình A + NaNO3 0,15 0,15 (mol) 0,15 0,3 (mol) 0,8 0,45 (mol) H+ dư, giá trị m nhỏ nhất để V lớn nhất ứng với NaNO3 phản ứng vừa hết m = 0,15.85 = 12,75 (gam) 0,5 ---------- 0,5 Câu 5 1,0đ 1. 200ml rượu 90o có Thể tích rượu 30o pha được từ 180 ml C2H5OH nguyên chất là -------------------------------------------------------------------------------------------------- Cách pha: Cho 200 ml rượu 90o vào cốc đong rồi thêm từ từ nước cất và lắc đều đến thể tích 600 ml thì dừng lại. 0,25 -------- 0,25 2. a. X: H – COOH (axit fomic); Y: CH3 – COOH (axit axetic); Z: CH2=CH – COOH (axit acrylic) b. Tính khối lượng CH3COOH trong dung dịch: 1 lít ancol etylic 9,2o có 92ml C2H5OH. = = 1,6 (mol) Men giấm C2H5OH + O2 CH3COOH + H2O Khối lượng CH3COOH = = 76,8 (gam) 0,25 0,25 Câu 6 2,0đ -------------------------------------------------------------------------------------------------- So sánh lực axit: D < B < C Giải thích: Nhóm NH2 đẩy electron vào vòng benzen làm giảm lực hút electron của vòng benzen nên D có lực axit yếu hơn B, còn nhóm NO2 hút electron ra khỏi vòng benzen làm tăng lực hút electron của vòng benzen nên B có lực axit yếu hơn C 0,5 0,25 2. a. Đốt 0,2 mol A cần Bảo toàn nguyên tố O được = 0,6.2 + 0,7 – 0,75.2 = 0,4mol A được cấu tạo từ C, H, O, N. Đặt CTTQ của A là CxHyOzNt, ta được CTPT của A là C3H7O2N. --------------------------------------------------------------------------------------------------------- b. A + HNO2 N2. Vậy A có nhóm -NH2. A + C2H5OH C5H11O2N. Vậy A có nhóm –COOH. A có trong tự nhiên A là - aminoaxit A hợp chất vòng có CT C6H11O2N2. Vậy A có CTCT: CH3 – CH(NH2) – COOH. Alanin (axit 2 – amino propanoic) --------------------------------------------------------------------------------------------------------------Các phương trình phản ứng: CH3 – CH(NH2) – COOH + HNO2 CH3 – CH(OH) – COOH + N2 + H2O CH3 – CH(NH2) – COOH + C2H5OH CH3 – CH(NH2) – COOC2H5 + H2O 0,5 -------- 0,5 -------- 0,25 Câu 7 1,0đ a. 20 ml dung dịch Y có 130 ml dung dịch Y có dư Đặt số mol FeSO4 và MSO4 lần lượt là x, y (mol) 2x + 2y = 0,06 x + y = 0,03 4Fe(OH)2 + O2 2Fe2O3 + 4H2O x 4M(OH)2 + (n-2)O2 2M2On + 4H2O (n = 2,3) y 160. + (2M + 16n). + 0,035.233 = 10,155 80x + My + 8ny = 2 *) n = 2 64x + My = 1,52 M < = 50,67 < 64 Do M(OH)2 không tan và không có tính lưỡng tính M =24 (Mg) 64x + 24y = 1,52 x = 0,02; y = 0,01 thỏa mãn *) n =3 56x + My = 1,28 M < = 42,67 < 56 Loại vì không có kim loại nào có hóa trị thay đổi thỏa mãn. ----------------------------------------------------------------------------------------------------- b. 0,5 Nếu HS không xét kim loại M có hóa trị thay đổi chỉ cho 0,25đ 0,5 8 1,5đ Áp dụng bảo toàn khối lượng, ta được: Áp dụng bảo toàn nguyên tố O, ta được nO/X = 0,44 + 0,57.2 – 0,66.2 = 0,26 mol số mol nhóm -COO- = = 0,13 mol ---------------------------------------------------------------------------------------- Gọi công thức ancol đơn chức Z là ROH, công thức trung bình của 4 este là nROH = nNaOH = n-COO- = 0,13 mol 2ROH + 2Na 2RONa + H2 0,13 0,065 (mol) mbình Na tăng = mROH - mROH = 5,85 + 0,065.2 = 5,98gam R + 17 = 46 R = 29 (C2H5-) ---------------------------------------------------------------------------------------- nNaOHbđ = 0,3.1 = 0,3 mol; nNaOH/Y = 0,3 – 0,13 = 0,27 mol Gọi công thức ba este hai chức là CnHm(COOC2H5)2 có số mol là x, công thức este đơn chức là CnHm+1 COOC2H5 có số mol là y. 0,04(n +6) + 0,05(n + 3) = 0,81 n = 2 0,02(m + 10) + 0,025(m + 6) = 0,44 m = 2 ---------------------------------------------------------------------------------------------------- CTPT, CTCT este đơn chức: C5H8O2 CH2=CH-COOC2H5 CTPT, CTCT của ba este hai chức: C8H12O4 CH2=C(COOC2H5)2 0,5 0,25 0,25 HS không xét số mol NaOH không tính điểm 0,5 -----------------------------Hết-----------------------------
Tài liệu đính kèm:
 3_DA_HOA_THPT 12_2015-2016.doc
3_DA_HOA_THPT 12_2015-2016.doc





