Chuyên đề Nitơ – amoniac – muối amoni
Bạn đang xem tài liệu "Chuyên đề Nitơ – amoniac – muối amoni", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
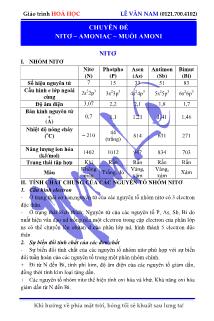
Khi hướng về phía mặt trời, bóng tối sẽ khuất sau lưng ta! Giáo trình HOÁ HỌC LÊ VĂN NAM (0121.700.4102) NITƠ I. NHÓM NITƠ Nitơ (N) Photpho (P) Asen (As) Antimon (Sb) Bimut (Bi) Số hiệu nguyên tử 7 15 33 51 83 Cấu hình e lớp ngoài cùng 2s 2 2p 3 3s 2 3p 3 4s 2 4p 3 5s 2 5p 3 6s 2 6p 3 Độ âm điện 3,07 2,2 2,1 1,8 1,7 Bán kính nguyên tử 0 (A) 0,7 1,1 1,21 1,41 1,46 Nhiệt độ nóng chảy ( o C) – 210 44 (trắng) 814 631 271 Năng lượng ion hóa (kJ/mol) 1402 1012 947 834 703 Trạng thái tập hợp Khí Rắn Rắn Rắn Rắn Màu Không màu Trắng, đỏ Vàng, xám Vàng, xám Xám II. TÍNH CHẤT CHUNG CỦA CÁC NGUYÊN TỐ NHÓM NITƠ 1. Cấu hình electron - Ở trạng thái cơ bản,nguyên tử của các nguyên tố nhóm nitơ có 3 electron độc thân. - Ở trạng thái kích thích: Nguyên tử của các nguyên tố P, As, Sb, Bi do xuất hiện vân đạo nd trống nên một electron trong cặp electron của phân lớp ns có thể chuyển lên obitan d của phân lớp nd, hình thành 5 electron độc thân 2. Sự biến đổi tính chất của các đơn chất - Sự biến đổi tính chất của các nguyên tố nhóm nitơ phù hợp với sự biến đổi tuần hoàn của các nguyên tố trong một phân nhóm chính. + Đi từ N đến Bi, tính phi kim, độ âm điện của các nguyên tố giảm dần, đồng thời tính kim loại tăng dần. + Các nguyên tố nhóm nitơ thể hiện tính oxi hóa và khử. Khả năng oxi hóa giàm dần từ N đến Bi. CHUYÊN ĐỀ NITƠ – AMONIAC – MUỐI AMONI Khi hướng về phía mặt trời, bóng tối sẽ khuất sau lưng ta! Giáo trình HOÁ HỌC LÊ VĂN NAM (0121.700.4102) III. ĐẶC ĐIỂM CẤU TẠO VÀ TÍNH CHẤT VẬT LÍ CỦA NITƠ 1. Đặc điểm cấu tạo - Cấu hình electron của N (Z=7): 1s22s22p3. N nằm ở ô thứ 7, chu kì 2, nhóm VA. - Công thức electron: N N công thức cấu tạo ( N N ) 2N - Hai nguyên tử nitơ liên kết với nhau bằng ba liên kết cộng hóa trị (gọi là liên kết ba gồm 1 liên kết và 2 liên kết ) bền vững N N(E 946 kJ/mol) và 0 N N(d 1,1 A ) nên nitơ khá trơ (kém hoạt động) ở nhiệt độ thường nhưng ở nhiệt độ cao N2 trở nên hoạt động hơn, đặc biệt khi có xúc tác. 2. Tính chất vật lí - Nitơ là chất khí không màu, không mùi, không vị, nhẹ hơn không khí, tan rất ít trong nước, không duy trì sự cháy và sự hô hấp của người và động vật hô hấp bằng oxi, N2 hóa lỏng ở–196 o C, hóa rắn ở –210oC - Khí N2 ít tan trong nước (25 ml khí N2 tan trong 1 lít nước), chiếm 80% thể tích của không khí. IV. TÍNH CHẤT HÓA HỌC - Bảng thể hiện số oxi hóa của các dạng hợp chất của Nitơ: 3 50 42 3 32 N NN NN (NH ) (HNO )(N ) ( )(NO) 2 NO TÝnh oxi hãa TÝnh khö - Đơn chất N2 thể hiện chủ yếu là tính oxi hóa vì nguyên tử N trong phân tử N2 có 5 electron hóa trị và có bán kính nguyên tử nhỏ: 3 2N 6e 2N - N2 chỉ thể hiện tính khử khi tác dụng với Flo, Oxi. 1. Nitơ thể hiện tính khử yếu 2 0 2 tia löa ®iÖn + O 22 2 2 tia löa ®iÖn 2 3 N O 2NO(N 2 N 2e) NO 2 N O 2NO 3 2. Nitơ thể hiện tính oxi hóa o 0 3t ,P,xt 22 2 3 N 3H 2NH (N 6e 2N) Khi hướng về phía mặt trời, bóng tối sẽ khuất sau lưng ta! Giáo trình HOÁ HỌC LÊ VĂN NAM (0121.700.4102) o o o o 2 t 2 3 2 600 C 2 3 2 t 2 3H O2000 C 2 2 2 3 3lß ®iÖn 3Ca N Ca N (Canxi nitrua) 3Mg N Mg N (Magie nitrua) Al N AlN (Nh«m nitrua) CaC N CaCN C CaCO 2NH (®Êt ®Ìn) (canxi xianamit) - Canxi xianamit là loại phân đạm hợp với đất chua vì tạo ra ion 4NH , cây có thể đồng hóa được. V. ĐIỀU CHẾ 1. Trong phòng thí nghiệm - Nhiệt phân NH4NO2 bão hòa o 2 4 4 2 t 2 2 4 2 NaNO NH Cl NaCl NH NO N 2H O NH NO - Một số phản ứng khác: o350 C 4 3 2 2 4 2 2 7 2 2 3 2 x y z t 2 2 2 2 1 NH NO N 2 x y yCuO N 2 (NH ) Cr O N Cr O 4H O y z y t C H O N x O xCO H O N 4 2 2 2 o o o 2 2 t x y t t O 2H O N O Cu 2. Trong công nghiệp - Sử dụng phương pháp chưng cất phân đoạn không khí lỏng. Sau khi đã loại bỏ CO2 và hơi nước, không khí được hóa lỏng dưới áp suất và nhiệt độ thấp. Nâng dần nhiệt độ không khí lỏng đến –196oC thì Nitơ sôi và được tách khỏi oxi lỏng vì O2 có nhiệt độ sôi cao hơn (–183 o C). Khí N2 được đựng trong bình thép nén dưới áp suất 150atm. - Cho không khí đi qua than nóng đỏ, tách loại CO và CO2, thu được N2. VI. TRẠNG THÁI TỰ NHIÊN VÀ ỨNG DỤNG 1. Trạng thái tự nhiên - Trong tự nhiên, N2 tồn tại ở dạng tự do và dạng hợp chất: + Ở dạng tự do: N2 chiếm khoảng 80% thể tích của không khí.N2 trong tự nhiên là hỗn hợp của 2 đồng vị: 14N và 15N. Khi hướng về phía mặt trời, bóng tối sẽ khuất sau lưng ta! Giáo trình HOÁ HỌC LÊ VĂN NAM (0121.700.4102) + Ở dạng hợp chất: N2 có nhiều trong khoáng vật Natri Nitrat, với tên gọi là diêm tiêu natri. N2 còn có trong thành phần của protein, axit nucleic,.. và nhiều hợp chất hữu cơ khác. 2. Ứng dụng - Là một trong những thành phần dinh dưỡng chính của thực vật. - Trong công nghiệp: phần lớn N2 sản xuất ra đươc dùng để tổng hợp NH3, từ đó sản xuất phân đạm, HNO3, - Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử sử dụng N2 làm môi trường trơ. - N2 lỏng dùng để bảo quản máu và các mẫu vật sinh học khác. AMONIAC 1. Đặc điểm cấu tạo và tính chất vật lí a. Đặc điểm cấu tạo Công thức electron Công thức cấu tạo Công thức phân tử H N H H H – N – H H 3NH - Cấu hình electron của N (Z = 7): 2 2 31s 2s 2p - Theo cơ học lượng tử: Nguyên tử N trong phân tử NH3 ở dạng lai hóa sp 3 tạo ra 4 obital lai hóa sp3, trong đó 3 AOsp3 có một electrong độc thân xen phủ với 3AO1s có 1 electron độc thân của 3 nguyên tử H tạo ra 3 liên kết NH tương dương nhau, còn một AOsp3 được chiếm cặp electron tự do 2s của N. - Góc HNH bằng o107 19' , liên kết N – H có độ dài khoảng 1,014 0 A và năng lượng liên kết trung bình N – H là 385 kJ/mol, momen lưỡng cực 3 2NH H O 1,48D 1,86D) ( . b. Tính chất vật lí - NH3 là chất khí không màu, mùi khai, dễ hóa lỏng (– 33,6 o C) và dễ hóa rắn (– 77,8oC). - Khí NH3 tan nhiều trong nước do tạo được liên kết hiđro với nước (ở 20 o C, 1 lít H2O hòa tan được 700 lít khí NH3 tạo ra dung dịch có khối lượng riêng d < 1). - Khí NH3 bay hơi, thu nhiệt nhiều nên NH3 lỏng còn được làm chất gây lạnh trong máy lạnh. Khi hướng về phía mặt trời, bóng tối sẽ khuất sau lưng ta! Giáo trình HOÁ HỌC LÊ VĂN NAM (0121.700.4102) 2. Tính chất hóa học a. Tính bazơ yếu: 3 2 4 NH H O NH OH 3 4 NH HCl NH Cl (bốc khói trắng) 3 3 2 3 4 AlCl 3NH 3H O Al(OH) 3NH Cl 3 2 3 2 2 4 3 Cu(NO ) 2NH 2H O Cu(OH) 2NH NO 2 3 3 4 2 Cu(OH) 4NH [Cu(NH ) ](OH) (Dung dịch xanh thẫm) - Trong chương trình phổ thông có Cu(OH)2. Zn(OH)2, AgOH, Cr(OH)3, Ni(OH)2 tạo phức với dung dịch NH3. b. Tính khử: o 3 0 t 23 2 2 N H 3CuO 3Cu N 3H O 3 0 23 2 2N H 3Cl N 6HCl o 3 2 Pt,850 C 3 2 2N H 5O 4NO 6HCl o 3 0 t 23 2 2 2 N H 3O 2 N 6H O . NH3 cháy trong oxi với ngọn lửa màu vàng, tạo ra N2 và H2O. 3. Điều chế và ứng dụng a. Điều chế - Trong phòng thí nghiệm: ot 4 2 2 3 2 2NH Cl Ca(OH) CaCl 2NH 2H O - Trong công nghiệp: ot ,P,xt 2 2 3 N 3H 2NH b. Ứng dụng - NH3 được sử dụng để sản xuất HNO3, phân bón, điều chế N2H4 làm nhiên liệu cho tên lửa. - NH3 lỏng được dùng làm chất gây lạnh trong máy lạnh. MUỐI AMONI 1. Tính chất vật lí - Là những tinh thể ion, tan dễ dàng trong nước. 2. Tính chất hóa học - Do có đôi electron chưa liên kết, nên NH3 là một hợp chất có hoạt tính hóa học cao. Khi hướng về phía mặt trời, bóng tối sẽ khuất sau lưng ta! Giáo trình HOÁ HỌC LÊ VĂN NAM (0121.700.4102) a. Phản ứng nhiệt phân - Muối amoni tạo bởi axit không có tính oxi hóa khi đun nóng phân hủy thành amoniac và axit ot 4 3 NH Cl NH HCl - Muối amoni tạo bởi axit có tính oxi hóa khi đun nóng phân hủy thành N2 hoặc N2O và H2O. ot 4 3 2 2 NH NO N O 2H O ot 4 3 2 2 2 2NH NO 2N O 4H O (Ở nhiệt độ cao) b. Phản ứng với dung dịch kiềm ot 4 3 2 NH Cl NaOH NaCl NH H O
Tài liệu đính kèm:
 CHUYEN_DE_NITO_AMONIAC_MUOI_AMONI.pdf
CHUYEN_DE_NITO_AMONIAC_MUOI_AMONI.pdf





