Chuyên đề bồi dưỡng học sinh giỏi hóa 9 Nhận biết và tách các chất vô cơ
Bạn đang xem tài liệu "Chuyên đề bồi dưỡng học sinh giỏi hóa 9 Nhận biết và tách các chất vô cơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
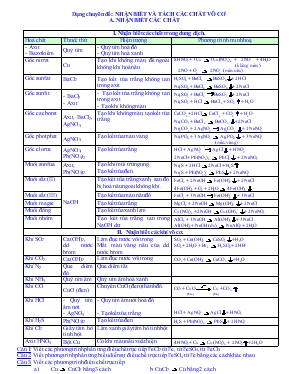
Dạng chuyên đề: NHẬN BIẾT VÀ TÁCH CÁC CHẤT VÔ CƠ A. NHẬN BIẾT CÁC CHẤT I. Nhận biết các chất trong dung dịch. Hoá chất Thuốc thử Hiện tượng Phương trình minh hoạ - Axit - Bazơ kiềm Quỳ tím - Quỳ tím hoá đỏ - Quỳ tím hoá xanh Gốc nitrat Cu Tạo khí không màu, để ngoài không khí hoá nâu 8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O (không màu) 2NO + O2 2NO2 (màu nâu) Gốc sunfat BaCl2 Tạo kết tủa trắng không tan trong axit H2SO4 + BaCl2 BaSO4+ 2HCl Na2SO4 + BaCl2 BaSO4+ 2NaCl Gốc sunfit - BaCl2 - Axit - Tạo kết tủa trắng không tan trong axit. - Tạo khí không màu. Na2SO3 + BaCl2 BaSO3+ 2NaCl Na2SO3 + HCl BaCl2 + SO2 + H2O Gốc cacbonat Axit, BaCl2, AgNO3 Tạo khí không màu, tạo kết tủa trắng. CaCO3 +2HCl CaCl2 + CO2 + H2O Na2CO3 + BaCl2 BaCO3 + 2NaCl Na2CO3 + 2AgNO3 Ag2CO3 + 2NaNO3 Gốc photphat AgNO3 Tạo kết tủa màu vàng Na3PO4 + 3AgNO3 Ag3PO4 + 3NaNO3 (màu vàng) Gốc clorua AgNO3, Pb(NO3)2 Tạo kết tủa trắng HCl + AgNO3 AgCl + HNO3 2NaCl + Pb(NO3)2 PbCl2 + 2NaNO3 Muối sunfua Axit, Pb(NO3)2 Tạo khí mùi trứng ung. Tạo kết tủa đen. Na2S + 2HCl 2NaCl + H2S Na2S + Pb(NO3)2 PbS+ 2NaNO3 Muối sắt (II) NaOH Tạo kết tủa trắng xanh, sau đó bị hoá nâu ngoài không khí. FeCl2 + 2NaOH Fe(OH)2 + 2NaCl 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 Muối sắt (III) Tạo kết tủa màu nâu đỏ FeCl3 + 3NaOH Fe(OH)3 + 3NaCl Muối magie Tạo kết tủa trắng MgCl2 + 2NaOH Mg(OH)2 + 2NaCl Muối đồng Tạo kết tủa xanh lam Cu(NO3)2 +2NaOH Cu(OH)2 + 2NaNO3 Muối nhôm Tạo kết tủa trắng, tan trong NaOH dư AlCl3 + 3NaOH Al(OH)3 + 3NaCl Al(OH)3 + NaOH (dư) NaAlO2 + 2H2O II. Nhận biết các khí vô cơ. Khí SO2 Ca(OH)2, dd nước brom Làm đục nước vôi trong. Mất màu vàng nâu của dd nước brom SO2 + Ca(OH)2 CaSO3 + H2O SO2 + 2H2O + Br2 H2SO4 + 2HBr Khí CO2 Ca(OH)2 Làm đục nước vôi trong CO2 + Ca(OH)2 CaCO3 + H2O Khí N2 Que diêm đỏ Que diêm tắt Khí NH3 Quỳ tím ẩm Quỳ tím ẩm hoá xanh Khí CO CuO (đen) Chuyển CuO (đen) thành đỏ. CO + CuO Cu + CO2 (đen) (đỏ) Khí HCl - Quỳ tím ẩm ướt - AgNO3 - Quỳ tím ẩm ướt hoá đỏ - Tạo kết tủa trắng HCl + AgNO3 AgCl+ HNO3 Khí H2S Pb(NO3)2 Tạo kết tủa đen H2S + Pb(NO3)2 PbS+ 2HNO3 Khí Cl2 Giấy tẩm hồ tinh bột Làm xanh giấy tẩm hồ tinh bột Axit HNO3 Bột Cu Có khí màu nâu xuất hiện 4HNO3 + Cu Cu(NO3)2 + 2NO2+ 2H2O Câu 1: Viết các phương trình phản ứng điều chế trực tiếp FeCl2 từ Fe, từ FeSO4, từ FeCl3. Câu 2: Viết phương trình phản ứng biểu diễn sự điều chế trực tiếp FeSO4 từ Fe bằng các cách khác nhau. Câu 3: Viết các phương trình điều chế trực tiếp: Cu CuCl2 bằng 3 cách. b. CuCl2 Cu bằng 2 cách. Fe FeCl3 bằng 2 cách. Câu 4: Chỉ từ quặng pirit FeS2, O2 và H2O, có chất xúc tác thích hợp. Hãy viết phương trình phản ứng điều chế muối sắt (III) sunfat. Câu 5: Chỉ từ Cu, NaCl và H2O, hãy nêu cách điều chế để thu được Cu(OH)2. Viết các PTHH xảy ra. Câu 6: Từ các chất KCl, MnO2, CaCl2, H2SO4 đặc. Hãy viết PTPƯ điều chế: Cl2, hiđroclorua. Câu 7: Từ các chất NaCl, KI, H2O. Hãy viết PTPƯ điều chế: Cl2, nước Javen, dung dịch KOH, I2, KClO3. Câu 8: Từ các chất NaCl, Fe, H2O, H2SO4 đặc. Hãy viết PTPƯ điều chế: FeCl2, FeCl3, nước clo. Câu 11: Hỗn hợp gồm CuO, Fe2O3. Chỉ dùng Al và HCl hãy nêu 2 cách điều chế Cu nguyên chất. Câu 12: Từ quặng pyrit sắt, nước biển, không khí, hãy viết các phương trình điều chế các chất: FeSO4, FeCl3, FeCl2, Fe(OH)3, Na2SO4, NaHSO4. * Phương trình khó: Chuyển muối clorua muối sunfat: cần dùng Ag2SO4 để tạo kết tủa AgCl. Chuyển muối sắt (II) muối sắt (III): dùng chất oxi hoá (O2, KMnO4,) Ví dụ: 10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O 4Fe(NO3)2 + O2 + 4HNO3 4Fe(NO3)3 + 2H2O Chuyển muối Fe(III) Fe(II): dùng chất khử là kim loại (Fe, Cu,...) Ví dụ: Fe2(SO4)3 + Fe 3FeSO4 2Fe(NO3)3 + Cu 2Fe(NO3)2 + Cu(NO3)2 * Phương trình khó: 2K3PO4 + H3PO4 3K3HPO4 K2HPO4 + H3PO4 2KH2PO4 * Phương trình khó: ZnO + 2NaOH Na2ZnO2 + H2O KHCO3 + Ca(OH)2 CaCO3 + KOH + H2O Ví dụ: 2N2 + 5O2 2N2O5 ; H2CO3 CO2 + H2O 3Fe + 2O2 Fe3O4 ; CaCO3 CaO + CO2 4FeS2 + 11O2 2Fe2O3 + 8SO2 ; Cu(OH)2 CuO + H2O 2Al + Fe2O3 Al2O3 + 2Fe Dạng 3: BÀI TOÁN VỀ ĐỘ TAN. Hướng giải: Dựa vào định nghĩa và dữ kiện bài toán ta có công thức: 1. Trong đó: S là độ tan là khối lượng chất tan 2. là khối lượng dung dịch bão hoà là khối lượng dung môi Bài tập: Câu 1: Xác định lượng NaCl kết tinh trở lại khi làm lạnh 548 gam dung dịch muối ăn bão hoà ở 50oC xuống OoC. Biết độ tan của NaCl ở 50oC là 37 gam và ở OoC là 35 gam. ĐS: Câu 2: Hoà tan 450g KNO3 vào 500g nước cất ở 2500C (dung dịch X). Biết độ tan của KNO3 ở 200C là32g. Hãy xác định khối lượng KNO3 tách ra khỏi dung dịch khi làm lạnh dung dịch X đến 200C. ĐS: Câu 3: Cho 0,2 mol CuO tan hết trong dung dịch H2SO4 20% đun nóng (lượng vừa đủ). Sau đó làm nguội dung dịch đến 100C. Tính khối lượng tinh thể CuSO4.5H2O đã tách khỏi dung dịch, biết rằng độ tan của CuSO4 ở 100C là 17,4g. ĐS: * Các cách điều chế 1. Điều chế oxit. Phi kim + oxi Nhiệt phân axit (axit mất nước) Kim loại + oxi OXIT Nhiệt phân muối Oxi + hợp chất Nhiệt phân bazơ không tan Kim loại mạnh + oxit kim loại yếu 2. Điều chế axit. Oxit axit + H2O Phi kim + Hiđro AXIT Muối + axit mạnh Ví dụ: P2O5 + 3H2O 2H3PO4 ; H2 + Cl2 2HCl 2NaCl + H2SO4 Na2SO4 + 2HCl 3. Điều chế bazơ. Kim loại + H2O Kiềm + dd muối BAZƠ Oxit bazơ + H2O Điện phân dd muối (có màng ngăn) Ví dụ: 2K + 2H2O 2KOH + H2 ; Ca(OH)2 + K2CO3 CaCO3 + 2KOH Na2O + H2O 2NaOH ; 2KCl + 2H2O 2KOH + H2 + Cl2 4. Điều chế hiđroxit lưỡng tính. Muối của nguyên tố lưỡng tính + NH4OH (hoăc kiềm vừa đủ) Hiđroxit lưỡng tính + Muối mới Ví dụ: AlCl3 + NH4OH 3NH4Cl + Al(OH)3 ZnSO4 + 2NaOH (vừa đủ) Zn(OH)2 + Na2SO4 5. Điều chế muối. a) Từ đơn chất b) Từ hợp chất Axit + Bzơ Kim loại + Axit Axit + Oxit bazơ Oxit axit + Oxit bazơ Kim loại + Phi kim MUỐI Muối axit + Oxit bazơ Muối axit + Bazơ Kim loại + DD muối Axit + DD muối Kiềm + DD muối DD muối + DD muối Các dạng bài tập cho hóa học 9 Dạng 1: Câu hỏi điều chế (Sơ đồ phản ứng – Điền chất và hoàn thành phương trình – Điều chế một chất từ nhiều chất) Dạng 2: NHẬN BIẾT VÀ TÁCH CÁC CHẤT VÔ CƠ A. Nhận biết các khí vô cơ. B. NHẬN BIẾT CÁC CHẤT C. CÂU HỎI TINH CHẾ VÀ TÁCH HỖN HỢP THÀNH CHẤT NGUYÊN CHẤT Dạng 3: BÀI TOÁN VỀ ĐỘ TAN DẠNG 4: BÀI TẬP VỀ CÔNG THỨC HOÁ HỌC Dạng 5: BÀI TOÁN NỒNG ĐỘ DUNG DỊCH Dạng 6: BÀI TOÁN VỀ LƯỢNG CHẤT DƯ Dạng 7: BÀI TOÁN XÁC ĐỊNH HỖN HỢP 2 KIM LOẠI (HOẶC 2 MUỐI) HAY AXIT CÒN DƯ Dạng 8: BÀI TOÁN TĂNG, GIẢM KHỐI LƯỢNG Dạng 9: BÀI TOÁN CÓ HIỆU SUẤT PHẢN ỨNG Dạng 10: BÀI TOÁN KHI GIẢI QUY VỀ 100 Dạng 11: BÀI TOÁN TỔNG HỢP Dạng 12: BÀI TOÁN BIỆN LUẬN * BÀI TOÁN XÁC ĐỊNH LOẠI MUỐI TẠO THÀNH KHI CHO CO2, SO2 TÁC DỤNG VỚI KIỀM. a) Phản ứng của CO2 hoặc SO2 tác dụng với kiềm của kim loại hoá trị I (Na, K,) CO2 + NaOH NaHCO3 CO2 + 2NaOH Na2CO3 + H2O Có 3 trường hợp xảy ra: Nếu 1 < < 2 tạo 2 muối Nếu 1 tạo muối NaHCO3 (3) Nếu 2 tạo muối Na2CO3 b) Phản ứng của CO2 hoặc SO2 với kiềm của kim loại hoá trị II (Ca, Ba,) 2CO2 + Ca(OH)2 Ca(HCO3)2 CO2 + Ca(OH)2 CaCO3 + H2O Có 3 trường hợp xảy ra: Nếu 1 < < 2 tạo 2 muối (2) Nếu 1 tạo muối CaCO3 (3) Nếu 2 tạo muối Ca(HCO3)2 * Lưu ý: Để biết loại muối tạo thành thường phải lập tỉ lệ giữa số mol kiềm và oxit. Chú ý lấy số mol của chất nào không thay đổi ở 2 phương trình làm mẫu số để xét bất đẳng thức. II. Phương pháp tách một số chất vô cơ cần lưu ý: Chất cần tách Phản ứng tách và phản ứng tái tạo lại chất ban đầu Phương pháp tách Al (Al2O3 hay hợp chất nhôm) Al NaAlO2 Al(OH)3Al2O3 Al Lọc, điện phân Zn (ZnO) Zn Na2ZnO2Zn(OH)2 ZnO Zn Lọc, nhiệt luyện Mg Mg MgCl2 Mg(OH)2MgO Mg Lọc, nhiệt luyện Fe (FeO hoặc Fe2O3) Fe FeCl2 Fe(OH)2FeO Fe Lọc, nhiệt luyện Cu (CuO) Cu CuSO4 Cu(OH)2CuO Cu Lọc, nhiệt luyện III. Bài tập: Câu 1: Tách riêng dung dịch từng chất sau ra khỏi hỗn hợp dung dịch AlCl3, FeCl3, BaCl2. Câu 2: Nêu phương pháp tách hỗn hợp gồm 3 khí: Cl2, H2 và CO2 thành các chất nguyên chất. Câu 3: Nêu phương pháp tách hỗn hợp đá vôi, vôi sống, silic đioxit và sắt (II) clorua thành từng chất nguyên chất. Câu 4: Trình bày phương pháp hoá học để lấy từng oxit từ hỗn hợp : SiO2, Al2O3, Fe2O3 và CuO. Câu 5: Trình bày phương pháp hoá học để lấy từng kim loại Cu và Fe từ hỗn hợp các oxit SiO2, Al2O3, CuO và FeO. PHƯƠNG PHÁP BẢO TOÀN LƯỢNG NGUYÊN TỐ PHƯƠNG PHÁP QUY ĐỔI TƯƠNG ĐƯƠNG I) KIẾN THỨC CẦN NHỚ: 1) Định luật bảo toàn nguyên tố : “ Tổng số mol nguyên tử của một nguyên tố hoặc nhóm nguyên tử trước phản ứng và sau phản ứng luôn bằng nhau” - Phạm vi áp dụng:Thường dùng cho các bài toán hỗn hợp phức tạp, chẳng hạn : các bài toán có phản ứng giữa các hỗn hợp muối, axit, bazơ hoặc bài toán có nhiều biến đổi rất phức tạp. Ví dụ 1 : hỗn hợp axit với hỗn hợp bazơ: yR(OH)x + xHyG RyGx + xyH2O Theo ptpư ta có : (sản phẩm) Vì vậy khi biết được số mol của nhóm OH thì tìm được số mol H trong axit , số mol H2O và ngược lại. Ví dụ 2: phản ứng nhiệt nhôm giữa a(mol) Al và b(mol) Fe2O3 theo sơ đồ : (a mol) (b mol) Al + Fe2O3 Vì S nFe ( trước pư ) = S nFe ( sau pư ) nên Þ ta luôn có : 2x + z + 3t + n = 2b Vì S nAl ( trước pư ) = S nAl ( sau pư ) nên Þ ta luôn có : y + 2n’ = a Ví dụ 3 : Điều chế H2SO4 từ a (gam) FeS2 ta dễ dàng thấy : Þ 2) Phương pháp quy đổi: Nguyên tắc : quy đổi hỗn hợp nhiều chất thành 1 chất hoặc một hỗn hợp có số lượng chất ít hơn. Ví dụ : Hỗn hợp Na2SO4 và K2SO4 tỷ lệ mol 1 :1 Û KNaSO4 Hỗn hợp FeO và Fe2O3 đồng mol Û Fe3O4 ( đúng cả 2 chiều ) 3) Kết hợp giữa bảo toàn nguyên tố và bảo toàn khối lượng. Phương pháp này thường được áp dụng trong các trường hợp sau đây : Thường gặp 2 trường hợp sau đây: * Trường hợp 1: Fe hoặc NO2 ...) Þ =( bđ ) ( muối) + ( các sp khí ) = ( các sp khí ). * Trường hợp 2 : Fe Þ = ( bđ ) ( muối) + ( các sp khí ) = ( các sp khí ). v.v. (còn nhiều trường hợp khác) Nhận xét: Nếu biết khối lượng của các khí sản phẩm và hỗn hợp A ( hoặc muối Fe) thì có thể áp dụng định luật BTKL. Ví dụ : Trường hợp 1 : giả sử biết m1 (g) ( Fe + FexOy) ; biết b (mol) khí NO sinh ra. Áp dụng định luật BTKL ta có : ( trong đó : ) II - Một số bài toán minh họa. 1) Để hòa tan hoàn toàn 34,8 gam hỗn hợp gồm Fe3O4 , FeO, Fe2O3 ( số mol FeO = số mol Fe2O3 ) thì phải dùng một lượng vừa đủ dung dịch H2SO4 4,9 % ( loãng). a) Tính khối lượng của dung dịch H2SO4 4,9% . b) Tính nồng độ % của các chất trong dung dịch thu được. Hướng dẫn: Vì số mol FeO = số mol Fe2O3 nên xem như Fe3O4. 2) Cho m(g) hỗn hợp FeO, Fe3O4, Fe2O3 tan vừa hết trong V (lít) dung dịch H2SO4 loãng thì thu được một dung dịch A. Chia đung dịch A làm 2 phần bằng nhau. Phần 1: tác dụng với dung dịch NaOH dư, lọc lấy kết tủa nung nóng trong không khí đến khối lượng không đổi thu được 8,8 gam chất rắn. Phần 2: làm mất màu vừa đúng 100ml dung dịch KMnO4 0,1M trong môi trường H2SO4 loãng dư. a) Viết các phương trình hóa học xảy ra. b) Tính m , V ( nếu dung dịch H2SO4 có nồng độ 0,5M). Hướng dẫn: Xem Fe3O4 như hỗn hợp FeO và Fe2O3 Vậy hỗn hợp xem như chỉ có FeO và Fe2O3 : số mol lần lượt x,y. * Có thể giải theo phương pháp bảo toàn nguyên tố Fe. ( các oxit ) = 2 ´ 0,055 = 0,11 mol ( FeO ) = Þ ( Fe2O3 ) = Vậy khối lượng hỗn hợp đầu : m = 2( 0,05 ´ 72 + ) = 16,8 gam. Số mol H2SO4 = 0,1 + (3 ´ 0,06) = 0,28 mol. Þ thể tích V = 0,56 lít. 3) Hỗn hợp A gồm FeO, Fe3O4, Fe2O3 ( với số mol bằng nhau). Cho m1(g) A vào ống sứ nung nóng rồi dẫn dòng khí CO đi qua ( CO pư hết ), thấy khí bay ra và trong ống còn lại 19,2 (g) rắn B (gồm Fe, FeO, Fe3O4) . Hấp thụ khí vào dung dịch Ba(OH)2 dư thì thu được m2 (g) kết tủa trắng. Hòa tan hết rắn B trong HNO3 nóng thì thấy bay ra 2,24 lít khí NO duy nhất ( đktc). a) Viết phương trình hóa học. b) Tính m1, m2 và số mol HNO3 đã phản ứng. Hướng dẫn: Xem phần FeO + Fe2O3 ( đồng mol) như Fe3O4 4) Đốt x (mol) Fe bởi O2 thu được 5,04 gam hỗn hợp A gồm các oxit của sắt. Hòa tan A trong HNO3 nóng dư thì thu được một dung dịch X và 0,035 mol khí Y ( gồm NO và NO2), biết = 19. Tính x. Hướng dẫn: Xem các oxit sắt chỉ gồm Fe2O3 và FeO ( vì Fe3O4 coi như FeO và Fe2O3) 5) Muối A là muối cacbonat của kim loại R hóa trị n ( R chiếm 48,28% theo khối lượng ). Nếu đem 58 gam A cho vào bình kín chứa sẵn lượng O2 vừa đủ rồi nung nóng. Phản ứng xong thu được 39,2 gam rắn B gồm Fe2O3 và Fe3O4. a) Xác định CTPT của A. b) Nếu hòa tan B vào HNO3 đặc nóng, thu được khí NO2 duy nhất. Trộn lượng NO2 này với 0,0175 mol khí O2 rồi sục vào lượng nước rất dư thì thu được 2 lít dung dịch X. Xác định nồng độ mol của các chất trong dung dịch X. Hướng dẫn: a) Ta có Þ R = 56 , n = 2 là thỏa mãn ( Fe) b) gọi x, y lần lượt là số mol Fe2O3 và Fe3O4 trong rắn B. 6) Hòa tan a gam một oxit sắt FexOy vào trong dung dịch H2SO4 đặc nóng dư thì thu được khí SO2 duy nhất.Mặt khác, nếu khử hoàn toàn a gam oxit sắt trên bằng khí CO, hòa tan lượng sắt tạo thành trong dung dịch H2SO4 đặc nóng (dư) thu được lượng SO2 gấp 9 lần lượng SO2 ở thí nghiệm trên. a) Viết các phương trình phản ứng xảy ra trong hai thí nghiệm trên. b) Xác định định công thức hóa học của oxit sắt. Giải mẫu : 2FexOy + (6x -2y )H2SO4 ( đặc) xFe2(SO4)3 + (3x-2y) SO2 + (6x -2y )H2O (1) a (mol) ® (mol) Fe xOy + yH2 xFe + yH2O (2) a (mol) ® ax (mol) 2Fe + 6H2SO4 ( đặc) Fe2(SO4)3 + 3SO2 + 6H2O (3) ax (mol) ® 1,5 ax ( mol) Theo đề bài : nên ta có : Þ Þ CTPT của oxit sắt là : Fe3O4. 7) Hòa tan một lượng oxit sắt FexOy vào dung dịch HNO3 loãng, dư thì thu được một dung dịch A và khí NO duy nhất. Mặt khác nếu khử lượng oxit sắt trên bằng lượng CO dư rồi lấy toàn bộ kim loại sinh ra hòa tan hoàn toàn trong dung dịch HNO3 đặc, nóng thì thu được dung dịch B và khí NO2 duy nhất. Biết thể tích khí NO2 sinh ra gấp 9 lần thể tích khí NO sinh ra ( cùng nhiệt độ, áp suất). a) Viết các phương trình hóa học. b) Xác định công thức hóa học của oxit sắt. Hướng dẫn : Giải như bài 6( FeO) 8) Để m gam một phoi bào sắt ( A ) ngoài không khí sau một thời gian thu được hỗn hợp B có khối lượng 12 gam gồm sắt và các oxit của sắt. Cho B tác dụng hoàn toàn với HNO3 loãng thấy giải phóng 2,24 lít khí NO ( đktc). Xác định m. Hướng dẫn : xem hỗn hợp B gồm Fe2O3, FeO, Fe ( vì Fe3O4 đã quy đổi) Kết hợp định luật BTNT và BTKL để giải. m = 10,08 gam 9) Có 190 ml dung dịch chứa đồng thời KOH và Ba(OH)2 có nồng độ tương ứng là 3M và 4M. Tính thể tích dung dịch Axit chứa đồng thời HCl 1,98M và H2SO4 1,1M đủ để trung hoà lượng dung dịch kiềm trên. Hướng dẫn: số mol OH của bazơ = số mol H của axit (V = 0,5 lít ) 10) Có 1 lít dung dịch hỗn hợp Na2CO3 0,1M và (NH4)2CO3 0,25M. Cho vào dung dịch đó 43 gam hỗn hợp BaCl2 và CaCl2 , sau khi kết thúc phản ứng thì thu được 39,7 gam kết tủa A và d.dịch B. a) Chứng minh hỗn hợp muối clorua đã phản ứng hết. b) Tính % khối lượng của các chất có trong kết tủa A. Hướng dẫn: a) Từ công thức Na2CO3 và (NH4)2CO3 Þ số mol CO3 = 0,35 mol Đặt RCl2 là công thức đại diện cho hỗn hợp BaCl2 và CaCl2 .Từ (1), (2) nhận thấy : Cứ 1 mol muối clorua biến thành kết tủa RCO3 thì khối lượng giảm 71 – 60 =11 g Chứng minh số mol CO3 phản ứng < 0,35 b) Gọi x, y là số mol của BaCO3 và CaCO3 trong kết tủa A, ta có: Vậy :
Tài liệu đính kèm:
 Chuyen_de_boi_duong_hoc_sinh_gioi_hoa_9_moi.doc
Chuyen_de_boi_duong_hoc_sinh_gioi_hoa_9_moi.doc





