Bài kiểm tra số 1 năm học 2014 - 2015 môn hóa khối 10 thời gian: 45 phút
Bạn đang xem tài liệu "Bài kiểm tra số 1 năm học 2014 - 2015 môn hóa khối 10 thời gian: 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
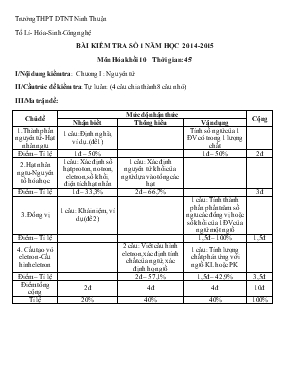
Trường THPT DTNT Ninh Thuận Tổ Lí- Hóa-Sinh-Công nghệ BÀI KIỂM TRA SỐ 1 NĂM HỌC 2014-2015 Môn Hóa khối 10 Thời gian: 45 ’ I/Nội dung kiểm tra: Chương I : Nguyên tử II/Cấu trúc đề kiểm tra: Tự luân: (4 câu chia thành 8 câu nhỏ) III/Ma trận đề: Chủ đề Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng 1.Thành phần nguyên tử- Hạt nhân ngtu 1 câu: Định nghĩa, ví dụ.(đề 1) Tính số ngtử của 1 ĐV có trong 1 lượng chất Điểm – Tỉ lệ 1đ – 50% 1đ – 50% 2đ 2. Hạt nhân ngtu- Nguyên tố hóa học 1 câu: Xác định số hạt proton, notron, eletron, số khối, điện tích hạt nhân 1 câu: Xác định nguyên tử khối của ngtử dựa vào tổng các hạt Điểm – Tỉ lệ 1đ – 33,3% 2đ – 66,7% 3đ 3. Đồng vị 1 câu: Khái niệm, ví dụ(đề 2) 1 câu: Tính thành phần phần trăm số ngtu các đồng vị hoặc số khối của 1ĐV của ngtử một ngtố Điểm – Tỉ lệ 1,5đ – 100% 1,5đ 4. Cấu tạo vỏ eletron-Cấu hình eletron 2 câu: Viết cấu hình eletron, xác định tính chất của ngtử, xác định họ ngtố 1 câu: Tính lượng chất phản ứng với ngtố KL hoặc PK Điểm – Tỉ lệ 2đ – 57,1% 1,5đ – 42,9% 3,5đ Điểm tổng cộng 2đ 4đ 4đ 10đ Tỉ lệ 20% 40% 40% 100% ĐỀ VÀ ĐÁP ÁN BÀI KIỂM TRA 1 TIẾT MÔN HÓA LỚP 10 ( BÀI SỐ 1) ĐỀ 1 Câu 1 (3,5đ): a) Đồng vị là gì? Cho ví dụ? b) Bo có 2 đồng vị 510B và 511B. Tính thành phần phần trăm số nguyên tử mỗi đồng vị và tính số nguyên tử đồng vị 510B có trong 14g B2O3 ( biết rằng nguyên tử khối trung bình của Bo là 10,81 và O = 16) Câu 2 (3đ): a)Cho 3580X 1.Xác định số proton, notron, eletron, nguyên tử khối, điện tích hạt nhân của X 2. Viết cấu hình eletron và xác định tính chất cơ bản của X b) Y có 4 lớp e và có 2e lớp ngoài cùng. Viết cấu hình eletron, xác định tính chất của Y (biết Y là nguyên tố họ s) Câu 3 (3,5đ): Tổng số các hạt trong nguyên tử của nguyên tố kim loại M là 58, trong đó số hạt mang điện hơn số hạt không mang điện là 18 hạt. a)Xác định nguyên tử khối của M và tên kim loại M b) Hòa tan hoàn toàn 5,85g kim loại M vào 44,15g nước được dd (Y). Tính nồng độ phần trăm của dd Y ( Na=23; K=39; H=1; O=16 ) ĐỀ 2 Câu 1 (3,5đ): a)Nguyên tố hóa học là gì? Cho ví dụ? b) Bo có 2 đồng vị, biết đồng vị thứ nhất là 511B chiếm 81%. Tìm nguyên tử khối của đồng vị thứ hai và tính số nguyên tử đồng vị thứ hai này có trong 18,6g H3BO3 (biết rằng nguyên tử khối trung bình của B là 10,81 và H = 1; O = 16) Câu 2 (3đ): a) Cho 3170X 1.Xác định số proton, notron, eletron, nguyên tử khối, điện tích hạt nhân của X 2. Viết cấu hình eletron của X 3. Xác định tính chất của X b) Cho Y có 3 lớp e và có lớp ngoài cùng có 6e. Viết cấu hình eletron của Y và Y là nguyên tố họ gì? Câu 3 (3,5đ): Tổng số các hạt trong nguyên tử của nguyên tố phi kim (X) là 52 trong đó số hat không mang điện kém số hat mang điện là 16 hạt. a) Xác định nguyên tử khối và tên của (X) b) Cho 11,2 lít khí X2 nói trên tác dụng hết vói khí H2, sản phẩm thu được hòa tan vào 200g nước thu được dung dịch (Y). Tính nồng độ phần trăm của dd (Y) ( H = 1; O = 16; Cl = 35, Br = 80) Đáp án đề số 1: Câu Lời giải tóm tắt Biểu điểm Câu 1 a) Đồng vị là những nguyên tử của cùng một nguyên tố có cùng số proton nhưng số notron khác nhau Ví dụ: Clo có 2 ĐV là 1735Cl (có số p = 17, số n =18) và 1737Cl (có số p = 17, số n = 20) b) Gọi x là % ĐV 510B=> % ĐV 511B là 100% - x = 1 – x Áp dụng công thức: MTB(X) = 10.x + 11(1 – x ) = 10,81 => x = 0,19 = 19% Vậy ĐV 510B chiếm 19% và ĐV 511B chiếm 81% 1 mol pt B2O3 → 2 mol nt B → 2.6,02.1023 nt B 1470 = 0,2 mol B2O3 → 0,2.2.6,02.1023 nt B => Số nt ĐV 510B = (0,2.2.6,02.1023).19/100 = 45,752.1021 3,5đ (1đ) 0,5đ 0,5đ (2,5đ) 0,25đ 1đ 0,25đ 0,5đ 0,5đ Câu 2 a) 1. Số proton: 35; số notron: 45; số eletron: 35; M x = 80(u); đthn: 35+ 2. 1s22s22p63s23p63d104s24p5 => X là phi kim( vì có 7e lớp ngoài cùng) b) Y: 1s22s22p63s23p64s2 => Y là kim loại( vì có 2e lớp ngoài cùng) vì là ngtố họ s 3đ (2đ) 1đ 1đ (1đ) 1đ Câu 3 a) Số p + số n + số e = 58 => 2Z + N = 58(1) Số hạt mang điện hơn hạt không mang điện là 18 => 2Z – N = 18(2) Từ (1) và (2): Z = 19; N = 20 => A = Z + N = 39 => M là Kali( K) b) nK = 5,85 : 39 = 0,15 mol Ptpứ: K + H2O → KOH + 1/2H2 (mol) 0,15 0,15 0,075 => mddKOH = 5,85 + 44,15 – 0,075x2 = 49,85g => C%ddKOH = (0,15x56x100) : 49,85 = 16,8% 3,5đ (2đ) 0,5đ 0,5đ 1đ (1,5đ) 0,25đ 0,25đ 0,5đ 0,5đ Đáp án đề số 2 Câu Lời giải tóm tắt Biểu điểm Câu 1 a) Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân Ví dụ: 2 dạng nguyên tử là 1735Cl và 1737Cl có cùng điện tích hạt nhân là 17+ đều thuộc cùng một nguyên tố Clo b) Gọi x là nguyên tử khối của ĐV thứ 2 (chiếm 19%) Áp dụng công thức: MB = 11.81+19x100 = 10,81 => x = 10 Vậy ĐV thứ 2 của B là 510B chiếm 19% 1 mol H3BO3 → 1 mol nt B → 6,02.1023 nt B 18,662 = 0,3mol → 0,3.6,02.1023 nt B => Số nt ĐV 510B = ( 0,3.6,02.1023).19/100 = 34,314.1021 3,5đ (1đ) 0,5đ 0,5đ (2,5đ) 0,25đ 1đ 0,25đ 0,5đ 0,5đ Câu 2 a) 1. 3170X có số p = 31; số n = 39; số e = 31; ĐTHN = 31+; M = 70(u) 2. 3170X: 1s2 2s22p63s23p63d104s24p1 => X là kim loại ( vì có 3e ở lớp ngoài cùng) b) Y: 1s22s22p63s23p4=> Y là phi kim( vì có 6e ở lớp ngoài cùng) và Y là nguyên tố họ p 3đ (2đ) 1đ 1đ 1đ Câu 3 a) Số p + số n + số e = 58 => 2Z + N = 52(1) Số hạt không mang điện kém hạt mang điện là 16 => 2Z – N = 16(2) Từ (1) và (2): Z = 17; N = 18 => A = Z + N = 35=> M là Clo( Cl) b) Số molCl2 = 11,2 : 22,4 = 0,5mol Ptpứ: Cl2 + H2 → 2HCl (mol) 0,5 1 => mddHCl = 1.36 + 200 = 236(g) C% ddHCl = (36.100) : 236 = 15,25% 3,5đ (2đ) 0,5đ 0,5đ 1đ (1,5đ) 0,25đ 0,25đ 0,5đ 0,5đ Lưu ý: HS có thể làm bằng cách khác nếu đúng vẫn được điểm tối đa Phan rang ngày 25 thang 9 năm 2014 PHT TTCM GVBM Nguyễn Thi Thu Thủy Tài Nhât Chuyên Huỳnh Thi Thu Thủy – Hồ Thị Quý
Tài liệu đính kèm:
 Hoa_Ch_(DTNT)_1_10.doc
Hoa_Ch_(DTNT)_1_10.doc





