Bài giảng Tiết 35: Kiểm tra học kỳ 1
Bạn đang xem tài liệu "Bài giảng Tiết 35: Kiểm tra học kỳ 1", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
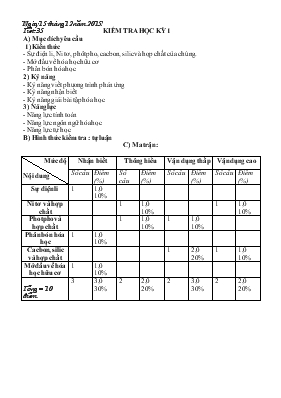
Ngày 15 tháng 12 năm 2015! Tiết 35 KIỂM TRA HỌC KỲ 1 A) Mục đích yêu cầu 1) Kiến thức - Sự điện li, Ni tơ, phôt pho, cacbon, silic và hợp chất của chúng. - Mở đầu về hóa học hữu cơ - Phân bón hóa học 2) Kỷ năng - Kỷ năng viết phương trình phản ứng - Kỷ năng nhận biết - Kỷ năng giải bài tập hóa học 3) Năng lực - Năng lực tính toán - Năng lực ngôn ngữ hóa học - Năng lực tự học B) Hình thức kiểm tra : tự luận C) Ma trận: Mức độ Nội dung Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Số câu Điểm (%) Số câu Điểm (%) Số câu Điểm (%) Số câu Điểm (%) Sự điện li 1 1,0 10% Ni tơ và hợp chất 1 1,0 10% 1 1,0 10% Photpho và hợp chất 1 1,0 10% 1 1,0 10% Phân bón hóa học 1 1,0 10% Cacbon, silic và hợp chất 1 2,0 20% 1 1,0 10% Mở đầu về hóa học hữu cơ 1 1,0 10% Tổng = 10 điểm 3 3,0 30% 2 2,0 20% 2 3,0 30% 2 2,0 20% D) Đề kiểm tra: Câu 1: (5 điểm). 1) Viết phương trình điện li của phân đạm (NH4)2SO4, NaNO3; phân kali K2SO4, KCl? Cây trồng hấp thụ phân đạm dưới dạng nào? Phân kali dưới dạng nào? 2) Viết phương trình phản ứng khi cho: HNO3, H3PO4, tác dụng với NH3, NaOH theo tỷ lệ mol 1: 1, gọi tên sản phẩm tạo thành ? 3) Lập 4 chất đầu dãy đồng đẳng của C6H6, CH3 – OH? Câu 2: ( 3 điểm). 1) Sục 2,24 lít CO2 (đktc) vào 150 ml dung dịch NaOH 1M thu được dung dịch A. Tính khối lượng các chất có trong dung dịch A? 2) Cho dung dịch A tác dụng với 100ml dung dịch B chứa Ba(OH)2 1M và KOH 0,5M. Tính khối lượng kết tủa thu được sau phản ứng? Câu 3: ( 2 điểm). 1) Tính thể tích khí NH3 (đktc) và khối lượng H3PO3 để điều chế được 1,235 tấn amophot (tỷ lệ mol NH4H2PO4 : (NH4)2 HPO4 = 1: 1) ? 2) Khi cho 5,4 gam kim loại Al tác dụng với dung dịch HNO3 loãng dư thu được dung dịch A chứa 45,0 gam muối. Thể tích khí (đktc) thoát ra ít nhất trong thí nghiệm là bao nhiêu lít? E) Đáp án và thang điểm: Câu Nội dung đáp án Điểm 1 5 điểm 1) (NH4)2SO4 = 2NH4+ + SO42- ; NaNO3= Na+ + NO3 phân kali: K2SO4 = 2K+ + SO42-; KCl = K+ + Cl- . Cây trồng hấp thụ phân đạm dưới dạng ion NH4+ hoặc NO3-. Cây trồng hấp thụ phân kali dưới dạng ion K+. 0,25.2 0,25.2 0,5 0,5 2) HNO3 + NH3 → NH4NO3 (amoni nitrat) HNO3 + NaOH →H2O + NaNO3 ( natri nitrat) H3PO4 + NH3 → NH4H2PO4 ( Amoni đihyđrophotphat) H3PO4 + NaOH → H2O + NaH2PO4 ( natri đihyđrophotphat) 0.5 0,5 0,5 0,5 3) Dãy đồng đẵng của C6H6: C6H6, C7H8, C8H10, C9H12. Dãy đồng đẳng của CH3 – OH: CH3 – OH, C2H5 – OH, C3H7 – OH, C4H9 – OH: 0,5 0,5 2 1) nNaOH = 0,15mol, nCO2 = 0,1 mol => T = 1,5 vậy phản ứng tạo hai muối. Phương trình pư: NaOH + CO2 → NaHCO3 (1) a a a 2NaOH + CO2 → Na2CO3 + H2O (2). 2b b b Gọi a, b là số mol NaHCO3 và Na2CO3 thu được ta có: a + b = 0,1 và 2a + b = 0, 15 => a = 0, 05 và b = 0,05 mol. = > m NaHCO3 = 0,05 .84 = 4,2 gam, mNa2CO3 = 0,05.106 = 5,3 gam. 0,5 0,25 0,25 0,5 0,5 2) Trong dung dịch A có: 0,05 mol HCO3- và 0,05 mol CO32-. Dung dịch B có: 0,1 mol Ba2+, 0,25mol OH-. Khi trọn dung dịch A và B thì có các pứ xẩy ra: HCO3- + OH- → CO32- + H2O. 0,05 0,25 0,05 + 0,05 Ba2+ + CO32- → BaCO3 ↓ 0,1 0,1 0,1 mol. Vậy khối lượng kết tủa thu được là 0,1 . 197 = 19,7 gam. 0,5 0,5 3 1) Phương trình điều chế amophot: NH3 + H3PO4 → NH4H2PO4 a a a mol 2NH3 + H3PO4 → (NH4)2HPO4 2a a a mol Theo bài ra ta có: 115a + 132a = 1235kg = > a = 5000mol Vậy thể tích NH3 ở đktc cần lấy là: 3x 5000x 22,4 = 336000 (lít) hay 336 m3. Khối lượng axit H3PO4 cần lấy là: 2 x 5000x 98= 980 kg . 0,25 0,25 0,25 0,25 2) Ta có: nAl = 0,2 mol => nAl(NO3)3 = 0,2 mol => mAl(NO3)3 = 42,6 gam. Vậy trong dung dịch có: 45,0 – 42,6 =2,4gam NH4NO3 ( 0,03mol) Thể tích khí thoát ra ít nhất trong thí nghiệm phải là khí N2 ( vì N2 nhận e nhiều nhất). Ta có: Qua trình oxi hóa: Quá trình khử: Al → Al3+ + 3e N+5 +8e → N-3 0,2 0,6 0,24 0,03 2N+5 +10e → N2 0,36 → 0,036 mol. Vậy thể tích khí thoát ra ít nhất ở đktc là 0,8064 lít. 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 De_ktra_hoc_ky_1.doc
De_ktra_hoc_ky_1.doc





