Bài giảng Tiết: 10: Kiểm tra một tiết
Bạn đang xem tài liệu "Bài giảng Tiết: 10: Kiểm tra một tiết", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
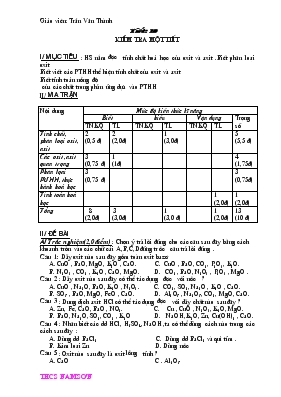
Tiết: 10 KIểm tra một tiết I/ Mục tiêu : HS nắm được tính chất hoá học của oxit và axit .Biết phân loại oxit Biết viết các PTHH thể hiện tính chất của oxit và axit Biết tính toán nồng độ của các chất trong phản ứng dựa vào PTHH II/ Ma trận Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Tính chất, phân loại oxit, axit 2 (0,5 đ) 2 (2,0đ) 1 (3,0đ) 5 (5,5 đ) Các oxit ,axit quan trọng 3 (0,75 đ) 1 (1đ) 4 (1,75đ) Phân lọai PƯHH, thực hành hoá học 3 (0,75 đ) 3 (0,75đ) Tính toán hoá học 1 (2,0đ) 1 (2,0đ) Tổng 8 (2,0đ) 3 (3,0đ) 1 (3,0 đ) 1 (2,0đ) 13 (10 đ) II/ đề bài A/ Trắc nghiệm(2,0 điểm) : Chọn ý trả lời đúng cho các câu sau đây bằng cách khoanh tròn vào các chữ cái A,B,C,D đứng trước câu trả lời đúng . Câu 1: Dãy oxit nào sau đây gồm toàn oxit bazơ CuO , BaO, MgO, K2O , CaO. C. CuO , BaO, CO2, P2O5, K2O. N2O5 , CO2 , K2O , CaO, MgO. D. CO2, BaO, N2O5 , P2O5 , MgO . Câu 2 : Dãy oxit nào sau đây có thể tác dụng được với nước ? CuO , Na2O, BaO, K2O , N2O5. C. CO2, SO2, Na2O , K2O , CaO. SO3 , BaO, MgO, FeO , CaO. D. Al2O3 , Na2O3, CO2, MgO, CaO. Câu 3 : Dung dịch axit HCl có thể tác dụng được với dãy chất nào sau đây ? Zn, Fe, CaO, BaO , NO2. C. Cu , CuO , N2O5, K2O, MgO. BaO, Na2O, SO2, CO2 , K2O D. NaOH, K2O, Zn, Cu(OH)2 , CaO. Câu 4 : Nhận biết các dd HCl, H2SO4, NaOH ,ta có thể dùng cách nào trong các cách sau đây : Dùng dd BaCl2 C. Dùng dd BaCl2 và quì tím . Kim loại Zn D. Dùng nước Câu 5 : Oxit nào sau đây là oxit lưỡng tính ? CaO C . Al2O3 B. BaO D. K2O Câu 6 : Khí O2 bị lẫn tạp chất là khí CO2, SO2 .Có thể dùng chất nào sau đây để loại bỏ tạp chất ? Nước C. dd Ca(OH)2 HCl D. dd CuSO4 Câu 7 : Những oxit tác dụng với dd NaOH là : A. CaO,CuO , Fe2O3 C. CuO , Al2O3, Fe2O3 B. SO2 , CO2, , P2O5 D. CaO, Na2O , FeO Câu 8 : Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ? A. CO 2 C. SO3 B. SO2 D. O2 B/ Tự luận (8,0 điểm) Câu 1(2,0 điểm) : Cho các oxit sau : CO2, SO2 , CaO, Na2O Hãy cho biết oxit nào tác dụng với : a/ dd HCl b/ dd NaOH Viết các PTHH Câu 2( 1,0 điểm) : Trình bày phương pháp hoá học phân biệt các dd : HCl , Na2SO4, H2SO4 Câu 3( 3,0 điểm) : Viết PTHH thực hiện các biến hoá sau : Ca " CaO " Ca(OH)2 " CaCO3 " CaO " CaCl2 " Ca Câu 4( 2,0 điểm) : Hoà tan hoàn toàn 6,5 g Zn bằng 500ml dd H2SO4 loãng dư. a/ Viết PTHH và tính thể tích khí thoát ra ở đktc b/ Tính nồng độ M của dd H2SO4 đã dùng. III. Đáp án Phần trắc nghiệm mỗi câu đúng được 0,25 điểm 1A,2C,3D,4C,5C,6C,7B,8B. Phần tự luận : Câu 1: HS viết đúng mỗi PTHH được 0,5 điểm a/ CaO + 2 HCl " CaCl2 + H2O Na2O + 2 HCl " 2 NaCl + H2O b/ CO2 +2 NaOH " Na2CO3 + H2O SO2 + 2NaOH " Na2SO3 + H2O Câu 2 : Dùng quì tím nhận ra HCl và H2SO4 vì 2 dd này làm quì tím chuyển sang màu đỏ .dd không làm đổi màu quì tím là Na2SO4 ( 0,5 điểm) Tiếp tục dùng dd BaCl2 nhận ra dd H2SO4 nhờ xuất hiện kết tủa trắng H2SO4 + BaCl2 " BaSO4 + 2 HCl dd còn lại không thấy có hiện tượng gì là dd HCl ( 0,5 điểm ) Câu 3 : HS viết đúng mỗi PTHH được 0,5 điểm 2Ca + O2 t" 2 CaO CaO + H2O " Ca(OH)2 Ca(OH)2 + CO2 " CaCO3 + H2O CaCO3 t" CaO + CO2 CaO + 2 HCl " CaCl2 + H2O Câu 4 : PTHH Zn + H2SO4 " ZnSO4 + H2 ( 0,5 điểm ) Theo PTHH ta có số mol H2 = số mol H2SO4 = số mol Zn = 6,5 /65 = 0,1 mol ( 0,5 điểm) Thể tích khí H2 ở đktc là : 0,1 . 22,4 = 2,24 (l) (0,5 điểm) Nồng độ mol của dd H2SO4 là : 0,1/0,5= 0,2M ( 0,5 điểm) ( Chú ý mỗi PTHH nếu HS viết thiếu trạng thái hoặc điều kiện bị trừ nửa số điểm của PTHH đó ) ********************************************************* Tiết: 20 KIểm tra một tiết I/ Mục tiêu : - Kiến thức :HS nắm được sự phân loại các bazơ và muối . Xác định được một phản ứng có xảy ra hay không xảy ra. Nắm được các phản ứng dùng để nhận biết các chất . Thực hành tính toán theo PTHH - Kĩ năng : Rèn kĩ năng viết PTHH và tính toán hoá học . - Thái độ : Giáo dục tính trung thực khi làm bài , đức tính cẩn thận cho HS. II/ Ma trận Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Tính chất ,phân loại bazơ, muối 6 (1,5 đ) 2 (1,5đ) 8 (3,0đ) Một số hợp chất quan trọng của bazơ và muối.Phân bón hoá học 2 0,5đ) 1 (0,5đ) 3 (1,0đ) Mối quan hệ giữa các loại hợp chất cô cơ 1(2,0đ) 1 (2,0đ) Phản ứng hoá học. Thực hành hoá học 1(1,0đ) 1 (1,0 đ) Tính toán hoá học 2 (3,0đ) 2 (3,0đ) Tổng 8 (2,0đ) 3 (2,0đ) 2 (3,0đ) 2 (3,0đ) 15 (10,0đ) II/ đề bài A/ Trắc nghiệm(2,0 điểm) : Chọn ý trả lời đúng cho các câu sau đây bằng cách khoanh tròn vào các chữ cái A,B,C,D đứng trước câu trả lời đúng . 1/ Cho các bazơ sau :NaOH, Ca(OH)2, Fe(OH)3 ,Mg(OH)2 . Dãy oxit nào sau đây tương ứng với các bazơ trên? A. Na2O, CaO, Fe2O3 ,MgO B. Na2O ,CaO, FeO, MgO C. Na2O2 , CaO, Fe2O3 ,MgO D. Na2O, CuO, Fe2O3 ,MgO 2/ Dãy bazơ nào sau đây bị nhiệt phân huỷ ? A. NaOH, KOH,Cu(OH)2 , Zn(OH)2 B. Cu(OH)2 , Zn(OH)2 , Mg(OH)2, Al(OH)3 C. Cu(OH)2 , Zn(OH)2 ,Ca(OH)2 , Mg(OH)2 D. Cu(OH)2 , Zn(OH)2 ,LiOH,Fe(OH)2 3/ Dãy bazơ nào sau đây tác dụng với khí CO2 ? A. NaOH, KOH,Ca(OH)2 , Ba(OH)2 B. . NaOH, KOH,Cu(OH)2 , Zn(OH)2 C. Ca(OH)2, KOH,Fe(OH)2 , Zn(OH)2 D. . Mg(OH)2, LiOH,Cu(OH)2 , Zn(OH)2 4/Một dd A có PH = 6,2 , dd B có PH = 4,8 ,dd C có PH = 6,9 , dd D có PH = 5,5 dd A có: A.Tính axit mạnh hơn dd B B. Tính axit mạnh hơn dd C C. Tính axit yếu hơn dd C D. Tính axit mạnh hơn dd D 5/ Trong các loại phân bón hoá học sau loại nào có hàm lượng N cao nhất ? A. Amonisunfat (NH4)2SO4 B. Amoninitơrat NH4NO3 C. Canxinitơrat Ca(NO3)2 D. Urê CO(NH2)2 6/ Trong các muối sau , muối nào có thể dùng để sản xuất ra thuốc nổ đen? A. NaCl B. KCl C. KNO3 D. Cả 3 muối trên 7/Dùng thuốc thử nào sau đây để nhận biết các chất chứa trong các ống nghiệm bị mất nhãn sau : CuSO4 ,AgNO3 ,NaCl A. Dùng dd BaCl2 B. Dùng dd NaOH C. Dùng quỳ tím D. Dùng dd Ba(NO)3 8/ dd muối BaCl2 tác dụng được với dãy chất nào sau đây? A .Fe, CuO, SO2 , NaOH C . NaOH, CuSO4, K2CO3 B .Fe, Cu, HCl, NaOH, D . CuSO4, H2SO4, Na2CO3 B/ Tự luận (8,0điểm) Câu 1(2,0 điểm) : Viết PTHH thực hiện chuyển đổi sau : Na2O NaOH Na2CO3 NaCl NaNO3 Câu 2 (2,0điểm) : Có các chất : Cu(OH)2 , AgNO3 ,HCl Hãy cho biết chất nào tác dụng với : a/ dd HCl b/ dd CuCl2 c/ Bị phân huỷ ở nhiệt độ cao Viết các PTHH xảy ra . Câu 3 (1,0 điểm) : Bằng phương pháp hoá học nào có thể phân biệt được 2 dd bazơ : NaOH và Ca(OH)2 ? Viết PTHH. Câu 4 (3,0điểm) : Hoà tan hoàn toàn 4 g hỗn hợp gồm 2 muối K2CO3 và NaCl bằng 200ml dd HCl thu được 0,448 l khí (đktc). a/ Viết PTHH xảy ra . b/ Tính CM của dd HCl đã dùng. c/ Tính thành phần % của mỗi muối trong hỗn hợp đầu . III/ Đáp án Phần trắc nghiệm mỗi câu đúng được 0,25 điểm 1B,2A,3A, 4B,5D,6C,7B,8D Phần tự luận Câu 1 : HS viết đúng 4 PTHH ,mỗi PTHH được 0,5 điểm Na2O + H2O 2NaOH 2NaOH + CO2 Na2CO3 + H2O Na2CO3 + 2HCl 2NaCl + H2O + CO2 NaCl + AgNO3 AgCl + NaNO3 Câu 2 : Các chất tác dụng với dd HCl : Cu(OH)2 , AgNO3 Chất tác dụng với dd CuCl2 : AgNO3 Các chất bị phân huỷ bởi nhiệt : Cu(OH)2 HS viết các PTHH mỗi PTHH được 0,5điểm Câu 3 : HS dùng khí CO2 nhận ra dd Ca(OH)2 nhờ hiện tượng làm đục nước vôi trong còn dd NaOH không làm đục nước vôi trong (0,5 đ) CO2 + Ca(OH)2 CaCO3 + H2O (0,5đ) Câu 4 : Số mol khí CO2: 0,448/22,4 = 0,02 mol Khi hoà tan hoàn toàn hỗn hợp bằng dd HCl chỉ có K2CO3 phản ứng , NaCl không phản ứng. (0,5đ) PTHH : K2CO3 + 2 HCl 2KCl + H2O + CO2 (0,5 đ) Tỉ lệ : 1 mol 2mol 1mol 0,02 mol 0,04 mol 0,02 mol (0,5 đ) Nồng độ CM của dd HCl đã dùng : 0,04 / 0,02 = 0,2 M (0,5đ) Khối lượng muối K2CO3 trong hỗn hợp : 0,02 . 138 = 2,76 g (0,5 đ) % k/l K2CO3 trong hỗn hợp đầu : 2,76/4.100% = 69% % k/l NaCl trong hỗn hợp đầu : 100% - 69% = 31% (0,5 đ) *********************************************************************** Kiểm tra học kì I A. Mục tiêu: 1. Kiến thức Thông qua bài kiểm tra đánh giá sự nắm bắt về thí nghiệm đã học các chuỗi phản ứng về mối liên hệ giữa đơn chất và hợp chất, các loại chất vô cơ. 2. Kĩ năng. - Viết đúng, viết đủ các phương trình hoá học biể diễn chuỗi phản ứng - Rèn luyện kĩ năng tính toán hoá học. B.Ma trận Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Tính chất của các hợp chất vô cơ 2(1,5 đ) 2 (1,5 đ) Tính chất hoá học của kim loại 1(0,5 đ) 2(2,0 đ) 3(2,5 đ) Nhôm –sắt – hợp kim sắt 1(1,0 đ) 1(1,0 đ) 2(2,0 đ) Dãy hoạt động hoá học của kim loại 1 (0,5đ) 1(0,5 đ) 1(0,5 đ) 3(1,5 đ) Mối liên hệ của các hợp chất vô cơ 1(0,5 đ) 2(2,0 đ) 3(2,5 đ) Tổng 4(2,5 đ) 5(4,0 đ) 4(3,5 đ) 13(10 đ) Đề bài Câu 1: Có các kim loại : Cu , Ag, Al và những dd muối CuSO4 ,AgNO3.Hãy cho biết những kim loại nào có thể tác dụng với những dd muối nào ? Viết các PTHH Câu 2 : Có 2 kim loại là nhôm và sắt .Hãy nêu phương pháp hoá học để phân biệt từng kim loại này. Câu 3 :Từ các chất : FeCl2 , Fe2O3 ,Fe. Hãy viết các PTHH điều chế FeCl3 từ mỗi chất đã cho . Câu 4: Hoàn thành các phương trình phản ứng cho sơ đồ sau: Cu Câu 5: Ngâm 12 g hỗn hợp các kim loại Fe và Cu trong dd CuSO4 dư. Phản ứng xong thu được chất rắn có khối lượng 12,8 g a/ Viết PTHH của các phản ứng hoá học xảy ra b/ Tính thành phần % theo khối lượng của hỗn hợp đầu. C. Đáp án và biểu chấm Câu 1 : 1,5 đ iểm Các PTHH: Cu + 2AgNO3 Cu(NO3) 2 + 2Ag 2Al + 3CuSO4 Al2(SO4)3 + 3 Cu 2Al + 3AgNO3 Al2(NO3)3 + 3Ag Câu 2: ( 2,0 đ) Dùng dd NaOH để nhận ra Al Fe không phản ứng với NaOH PTHH : Al + H2O + NaOH NaAlO2 + H2 Câu 3: ( 1,5 điểm) HS có thể viết các PTHH sau 2FeCl2 + 3 Cl2 2 FeCl3 (0,5 đ) Fe2O3 + 6 HCl 2 FeCl3 + 3H2O (0,5 đ) 2Fe + 3 Cl2 2 FeCl3 (0,5 đ) Câu 4 : 2,5điểm Cu + Cl2 CuCl2 CuCl2 + 2AgNO3 Cu(NO3)2 + 2AgCl Cu(NO3)2 +2 NaOH Cu(OH)2 + 2NaNO3 Cu(OH)2 CuO + H2O CuO + H2 Cu + H2O Câu 5 :2,5 điểm Fe + CuSO4 FeSO4 + Cu ( 0,5 đ) Theo PTHH cứ 56 g Fe phản ứng làm khối lượng tăng 64-56= 0,8 g (0,75 đ) Vậy 5,6 g ...............................................................12,8-12=0,8 g %Fe =5,6/12.100 = 46,7% %Cu = 100% - 46,7% = 53,3% ******************************************************************** Đề kiểm tra tiết 48 I Mục tiêu : 1. Kiến thức : Hiểu khái niệm hợp chất hữu cơ , biết phân loại hợp chất hữu cơ ,biết viết CTCT của một số chất hữu cơ thường gặp . - Nắm được công thức cấu tạo , tính chất hoá học của các chất : CH4 ,C2H4 ,C2H2 - tính chất của một số phi kim 2. Kĩ năng : Rèn kĩ năng viết PTHH Kĩ năng viết CTCT , vận dụng tính toán theo PTHH Kĩ năng làm bài kiểm tra II.Ma trận Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Định nghĩa , phân loại 2 (0,5 đ) 1 (0,5 đ) 3 (1 đ) CTCT 1 (1đ) 1 (1đ) Tính chất hoá học của CH4, C2H4 , C2H2 2 (0,5 đ) 1 (1đ) 2 (0,5 đ) 1 (2,0 đ) 8 (4đ) Phi kim . Mối liên hệ giữa các hợp chất vô cơ 1 (2đ) 1 (1 đ) 2 (0,5đ) 4 (4 đ) Tổng 4 (1đ) 3 (4đ) 2 (0,5 đ) 2 (2 đ) 2 (0,5đ) 1 (2,0đ) 15 (10 đ) III. Đề bài Trắc nghiệm : 2,0 điểm Hãy chọn phương án đúng cho các câu sau đây bằng cách đánh dấu x vào đầu câu trả lời đúng : 1/ Trong các dãy chất sau dãy nào gồm toàn hợp chất hữu cơ ? Muối ăn , đường kính ,cồn ,bột gạo ,xăng. Mỡ ,bơ , sữa đậu nành, dầu ăn, dầu hoả. Kim cương , khí oxi, đá vôi , giấm ăn , muối iốt. 2/ Chọn thí nghiệm nào sau đây để để nhận biết một chất có phải là hợp chất hữu cơ không? Đốt cháy hoàn toàn. Cho tác dụng với nước vôi trong dư. Cho tác dụng với P2O5. Cả 3 thí nghiệm trên. 3/ Chất khí nào sau đây không thể làm mất màu dd nước Brôm ? CH4 B. C2H4 C. C2H2 D. CO2 4/ Phương pháp nào sau đây là tốt nhất để phân biệt khí CH4 và khí C2H4 ? Dựa vào tỉ lệ về thể tích khí oxi tham gia phản ứng cháy Sự thay đổi màu của dd Brôm. So sánh khối lượng riêng. Thử tính tan trong nước. 5/Một hiđrocacbon cháy hoàn toàn trong O2 sinh ra 8,8g CO2 và 3,6g H2O. CTHH của hiđrocacbon này là : A. CH4 B. C2H4 C. C2H2 D.C6H6 6/ Có 3 bình chứa các khí : CH4 , C2H4 , CO2 . Dùng cách nào trong các cách sau đây có thể nhận biết 3 khí trên ? Dùng nước vôi trong dư , dùng dd Brôm . Dùng dd Brôm. Đốt cháy , dùng nước vôi trong dư . Dùng quì tím ẩm , đốt cháy , dùng nước Brôm. 7/ Khi cho hỗn hợp khí CH4 , C2H4 ( ở đktc) đi qua dd Brôm thì lượng brôm tham gia phản ứng là 8g . thể tích khí bị brôm hấp thụ là : A. 2,24 l B. 3,36l C. 1,12l D. 5,6l 8/ Chọn những hoá chất nào sau đây để điều chế khí C2H2 trong phòng thí nghiệm? A. Đất đèn , nước B. Đá vôi, HCl C. Nước D. H2SO4 B. Tự luận (8,0 điểm) 1/ ( 1 đ) Hãy viết các CTCT có thể có của chất có công thức phân tử là C3H6 2/ ( 3,0 đ) Thực hiện các biến hoá hoá học sau : CaC2 C2H2 C2H4 C2H4Br C CO2Ca (HCO3)2 CO2 3/ ( 0,5 đ) Hợp chất hữu cơ được chia làm mấy loại ? hãy phân loại các hợp chất sau đây : CH4 , CH3Cl , C2H4 , C6H6 , C2H6O ,CH3Br ,C6H12O6 4/ (1,5 đ) Nêu phương pháp hoá học dùng để phân biệt các khí đựng trong các bình riêng biệt sau : CH4 , C2H2 , CO2 5/ (2,0 đ)Cho 1,12 l khí clo ( ở đktc) tác dụng với H2 dư . Hấp thụ toàn bộ sản phẩm vào 100g nước thu được dd A . Tính nồng độ mol của dd A. IV .Đáp án 2,0 điểm . Mỗi câu trả lời đúng 0,25 điểm 1B, 2D, 3A, 4 B, 5 B , 6 A, 7C, 8A B . 8,0 điểm 1/ 1,0 điểm. 2 công thức , mỗi CT đúng 0,5 điểm 2/ 3,0 điểm . HS viết đúng mỗi PTHH được 0,5 điểm 3/ 0,5 điểm : HS phân làm 2 nhóm hiđrocacbon và dẫn xuất của hiđrocacbon 4/ 1,5 điểm Dùng dd nước Br2 nhận ra khí C2H2 Dùng dd nước vôi trong nhận ra khí CO2 Khí còn lại là CH4 HS viết 2 PTHH 5/ 2,0 điểm Số mol khí Cl2 : 1,12/22,4 = 0,05 mol (0,5,đ) PTHH : Cl2 + H2 2 HCl (0,5 đ) Theo PTHH vì H2 dư nên số mol HCl tính theo Cl2 nHCl= 0,05 . 2 = 0,1 mol (0,5 đ) CM của dd HCl = 0,1/0,1= 1M (0,5đ) ***************************************************** Đề kiểm tra tiết 57 1.Kiến thức: - Đáng giá kiến thức, khả năng tiếp thu kiến thức của HS trong ch ơng 5. 2. Kỹ năng: - Rèn luyện tính cẩn thận trình bày khoa học. 3. Thái độ tình cảm - Giáo dục lòng yêu môn hóa, tính cẩn thận. II. Thiết lập ma trận hai chiều: Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Metan, etilen ,Benzen 1( 0,25đ) 1(1,0 đ) 2(1,25đ) Axitaxetic 1(0,25đ) 1(0,5 đ) 1( 0,25đ) 2(1,0 đ) 1(2,5 đ) 6(4,5đ) Rượu etilic 1(0,5đ) 1(0,25đ) 2(1,0 đ) 1(2,5 đ) 5 (4,25đ) Tổng 2( 0,5đ) 2(1,0 đ) 2(0,5đ) 4(2,0 đ) 1(1,0 đ) 2(5,0 đ) 13(10 đ) III. Đề bài: Trắc nghiệm (2,0 điểm) Khoanh tròn vào chữ cái đứng trước đầu câu đúng: 1/ Cặp chất nào sau đây tham gia phản ứng este hóa: A. C2H2, CH3COOH B. CH3COOH, C2H5OH C. CH3Cl, CH3COOH D. CH3OH, C2H5OH 2/. Dãy chất nào sau đây tác dụng được với dung dịch CH3COOH. A. NaOH, H2CO3, Na, C2H5OH B. Cu, C2H5OH, CaCO3, KOH C. KOH, NaCl, Na, C2H5OH D. C2H5OH, NaOH, Zn, CaCO3 3/ Nhóm chất nào sau đây thuộc dẫn xuất hiđrocacbon: A.CH4, C3H8 B. CH3COOH, C3H7OH C. C2H5OH, CH4 D. C2H6 , C4H10 4/ Khi cho hỗn hợp khí CH4 và C2H4 (ở đktc) đi qua dd Brôm thì lượng brom tham gia phản ứng là 8 g . Thể tích khí bị brom hấp thụ là : A. 2,24 l B. 3,36 l C.1,12 l D. 5,6 l 5/ Ben zen phản ứng được với tất cả các chất trong nhóm chất nào sau đây: A.O2 ,Cl2 ,HBr B. dd brom , H2 ,Cl2 C. H2 , Cl2 , HNO3 D. H2 ,KMnO4 ,C2H5OH Tự luận (8,0 điểm) Câu 1: Viết phư ơng trình thực hiện chuỗi biến hóa: C2H4 C2H5 OH CH3COOH CH3COOC2H5 Câu 2 : Có 3 chất lỏng : Rượu etilic,axitaxetic và benzen .Hãy trình bày phương pháp hoá học phân biệt chúng . Câu 3: Hỗn hợp X gồm axit axetic và rư ợu etylic. Cho m g hồn hợp X tác dụng vừa đủ với dung dịch NaOH 0,1M thì hết 200ml. Mặt khác cho m g hỗn hợp X tác dụng hết với Na d ư thấy thoát ra 0,336l khí H2 ( ĐKTC). a. Viết ph ương trình hóa học xảy ra. b. Hãy xác định m. C. Đáp án - biểu điểm: Câu Đáp án Điểm Trắc nghiệm Câu 1: Câu 2: Câu 3: Câu 4: Câu 5 : Tự luận Câu 1: 1,5 đ Câu 2 : 2,5 đ Câu 3: 4,0đ Chọn B Chọn D Chon B Chọn C Chọn C C2H4 + H2O axit C2H5OH C2H5OH + O2 Men dấm CH3COOH + H2O H2SO4đ, t0 CH3COOH + C2H5OH CH3COOC2H5 + H2O Dùng quì tím nhận ra axit Dùng Na nhận ra rượu etilic 2Na + 2C2H5OH 2 C2H5ONa + H2 Còn lại là ben zen a. PTHH xảy ra: CH3COOH + NaOH CH3COONa + H2O ( 1) 2CH3COOH + Na CH3COOna + H2 ( 2) 2C2H5OH + 2 Na 2 C2H5ONa + H2 ( 3) Theo đề bài: n NaOH = 0,1. 0,2 = 0,02 mol Theo PT (1) n CH3COOH = 0,02 mol Theo PT (2) n H2 = 1/2 n CH3OOOOH = 0,01mol 0,336 Theo đề bài: nH2 = = 0,015 mol 22,4 Vậy nH2 ở PT (3) = 0,015 - 0,01 = 0,005 mol Vây m hh = 0,02 . 60 + 0,01. 46 = 1,66g 0,5đ 0,5đ 0,25 đ 0,5 đ 0,25đ 0,5đ 0,5đ 0,5đ 0,5đ 0,75đ 0,75đ 0,5đ 0,5đ 0,5đ 0,5đ 0,25đ 0,25 đ 0,25đ 0,25đ 0,75đ 0,75 đ **************************************************** Đề kiểm tra học kì 2 I/ Mục tiêu : 1.Kiến thức: - Đáng giá kiến thức, khả năng tiếp thu kiến thức của HS trong học kì 2 2. Kỹ năng: - Rèn luyện tính cẩn thận trình bày khoa học.Rèn kĩ năng viết PTHH và tính toán dựa vào PTHH 3. Thái độ tình cảm - Giáo dục lòng yêu môn hóa, tính cẩn thận. II/ Ma trận Nội dung Mức độ kiến thức kĩ năng Biết hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Phi kim ,mối quan hệ giữa các chất vô cơ 2(1,0 đ) 2(1,5 đ) 4(2,5 đ) Hiđro cacbon 1(0,5 đ) 1(0,5đ) Dẫn xuất hiđrocacbon 1(1,0đ) 1(1,0 đ) 4(5,0 đ) 4(7,0đ) Tổng 3(2,0 đ) 4(3,0 đ) 4(5,0 đ) 11(10 đ) Đề bài Câu 1/ Những cặp chất nào dưới đây có thể tác dụng với nhau ? Viết các PT hoá học (nếu có ): a. SiO2 và CO2 b. SiO2 và NaOH c. SiO2 và CaO c. SiO2 và H2SO4 e. SiO2 và H2O Câu2/Trong phòng thí nghiệm có các hoá chất sau : dd HCl, KMnO4 ,MnO 2 , NaCl, H2O. Để điều chế clo, emcó thể dùng những hoá chất nào? Viết các PTHH . Câu3/ Trình bày phương pháp hoá học để nhận biết 4 chất lỏng sau : Benzen,rượu etilic ,axitaxetic ,dd glucozơ đựng riêng biệt trong 4 ống nghiệm . Câu 4/Viết các PTHH thực hiện dãy chuyển đổi hoá học sau Tinh bột Glucozơ Rượuetilic axitaxetic Natriaxetat Câu 5/Cho glucozơ lên men thành rượu etilic. Dẫn toàn bộ lượng khí CO 2 sinh ra đi vào dd Ca(OH)2 dư thu được 50g kết tủa. Tính khối lượng rượu thu được và khối lượng glucozơ đã lên men . Biết hiệu suất lên men đạt 80% . Đáp án 1/ 1,0 điểm a.SiO2 + CaO CaSiO3 c . SiO2 + 2 NaOH Na2SiO3 + H2O 2/ 1,5 điểm 4HCl + MnO2 MnCl2 + Cl2 + 2 H2O 2NaCl +2H2O 2NaOH + H2 + Cl2 2 KMnO4 + 16 HCl 2 KCl + 2MnCl2 + 5 Cl2 + 8 H2O 3/ 2,5 điểm Dùng quì tím nhận ra axitaxetic Dùng Na nhận ra rượu etilic 2Na + 2C2H5OH 2 C2H5ONa + H2 Dùng phản ứng tráng gương nhận ra glucozơ C6H12O6 + Ag2O C6H12O7 + 2Ag Chất còn lại là benzen 4/ 2,0 điểm HS viết đúng mỗi PTHH được 0,5 điểm (C6H10O5)n + nH2O n C6H12O6 C6H12O6 2 C2H5OH + 2CO2 CH3CH2OH + O2 men dấmCH3COOH + H2O CH3COOH (dd) + C2H5OH (dd) CH3COONa (dd) + H2O 5/ 3,0 điểm C6H12O6 2 C2H5OH + 2CO2 (1) 0,5 đ CO2 + Ca(OH)2 CaCO3 + H2O (2) 0,5 đ Theo (2) (1) số mol C6H12O6 = 1/2 số mol CO2 = 0,25 mol 0,5 đ Khối lượng glucozơ lên men là : 180 .0,25. 80 /100 = 36 g 0,75 đ khối lượng rượu thu được là : 46. 0,5.80/100 = 18,4 g 0,75 đ ( Chú ý các PTHH phải ghi đủ điều kiện , trạng thái các chất )
Tài liệu đính kèm:
 BO_DE_KIEM_TRA_HOA_9.doc
BO_DE_KIEM_TRA_HOA_9.doc





