Đề thi học kỳ I - Năm học 2016 - 2017 môn: Hóa học – Khối lớp 9 - Đề A
Bạn đang xem tài liệu "Đề thi học kỳ I - Năm học 2016 - 2017 môn: Hóa học – Khối lớp 9 - Đề A", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
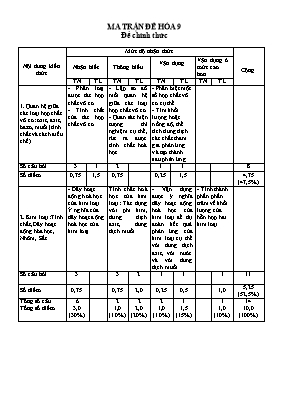
Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. Quan hệ giữa các loại hợp chất vô cơ: oxit, axit, bazơ, muối (tính chất và cách điều chế) - Phân loại được các hợp chất vô cơ - Tính chất của các hợp chất vô cơ - Lập sơ đồ mối quan hệ giữa các loại hợp chất vô cơ. - Quan sát hiện tượng thí nghiệm cụ thể, rút ra được tính chất hoá học - Phân biệt một số hợp chất vô cơ cụ thể. - Tìm khối lượng hoặc nồng độ, thể tích dung dịch các chất tham gia phản ứng và tạo thành sau phản ứng. Số câu hỏi 3 1 2 1 1 8 Số điểm 0,75 1,5 0,75 0,25 1,5 4,75 (47,5%) 2. Kim loại: Tính chất, Dãy hoạt động hóa học, Nhôm, Sắt - Dãy hoạt động hoá học của kim loại. Ý nghĩa của dãy hoạt động hoá học của kim loại. Tính chất hoá học của kim loại: Tác dụng với phi kim, dung dịch axit, dung dịch muối. - Vận dụng được ý nghĩa dãy hoạt động hoá học của kim loại để dự đoán kết quả phản ứng của kim loại cụ thể với dung dịch axit, với nước và với dung dịch muối. - Tính thành phần phần trăm về khối lượng của hỗn hợp hai kim loại. Số câu hỏi 3 3 2 1 1 1 11 Số điểm 0,75 0,75 2,0 0,25 0,5 1,0 5,25 (52,5%) Tổng số câu Tổng số điểm 6 3,0 (30%) 2 1,0 (10%) 2 2,0 (20%) 2 1,0 (10%) 1 1,5 (15%) 1 1,0 (10%) 14 10,0 (100%) MA TRẬN ĐỀ HÓA 9 Đề chính thức PHÒNG GD&ĐT MANG THÍT TRƯỜNG THCS LONG MỸ (Không kể thời gian phát đề) ĐỀ THI HỌC KỲ I - NĂM HỌC 2016 - 2017 MÔN:HÓA HỌC – KHỐI LỚP 9 Thời gian làm bài : 60 phút ĐỀ A ĐỀ CHÍNH THỨC I. TRẮC NGHIỆM (3 điểm) Hãy khoanh tròn vào câu trả lời đúng: Câu 1: Khí SO2 phản ứng được với tất cả các chất trong dãy nào sau đây ? A. CaO ; K2SO4 ; Ca(OH)2 B. NaOH ; CaO ; H2O C. Ca(OH)2 ; H2O ; BaCl2 D. NaCl ; H2O ; CaO Câu 2: Dãy gồm các chất toàn là oxit axit là A. CaO, CO2, CO B. CO2, Na2O, MgO C. CO2, SO2, P2O5 D. CaO, P2O5, Na2O Câu 3: Dãy gồm các chất toàn là muối A. NaCl, MgSO4, CuCl2 B. MgSO4, CuCl2, NaOH C. CuCl2, HCl, Na2CO3 D. H2O, NaOH, CuSO4 Câu 4. Thí nghiệm bột nhôm tác dụng với oxi được tiến hành bằng cách Cho bột nhôm vào muỗng sắt và đốt trên ngọn lửa đèn cồn B. Cho bột nhôm vào muỗng sắt hơ nóng và đưa vào bình chứa oxi Lấy bột nhôm vào mãnh bìa cứng và rắc nhẹ trên ngọn lửa đèn cồn D. lấy thìa sắt xúc bột nhôm đổ lên ngọn lửa đèn cồn Câu 5. Cặp chất nào sau đây có phản ứng tạo thành sản phẩm là chất khí A. Dung dịch Na2SO4 và dung dịch BaCl2 B. Dung dịch Na2CO3 và dung dịch HCl C. Dung dịch KOH và dung dịch MgCl2 D. Dung dịch KCl và dung dịch AgNO3 Câu 6. Dãy gồm các kim loại được sắp theo chiều tăng dần về hoạt động hoá học là A. Na ; Al ; Fe ; Cu ; K ; Mg B. Cu ; Fe ; Al ; K ; Na ; Mg C Fe ; Al ; Cu ; Mg ; K ; Na D. Cu ; Fe ; Al ; Mg ; Na ; K. Câu 7 : Dãy gồm các kim loại đều tác dụng với H2SO4 loãng là A. Na ; Cu ; Mg B. Zn ; Mg ; Al C. Na ; Fe ; Cu D. K ; Na ; Ag Câu 8: Dãy kim loại nào sau đây đều phản ứng với nước ở nhiệt độ thường ? A. Na, Ag B. K, Ca C. Zn, Cu D. Fe, K Câu 9: Thí nghiệm hóa học nào giúp ta hiểu được lý do không nên dùng dụng cụ bằng nhôm để đựng vôi, nước vôi tôi,vữa xây dựng A. Nhôm tác dụng với nước B. Nhôm tác dụng với dung dịch muối C. Nhôm tác dụng với dung dịch kiềm D. Nhôm tác dụng với dung dịch axit Câu 10: Kim loại nào có thể phản ứng được với dung dịch muối đồng sunfat A. Fe B. Ag C. Pb D. Hg Câu 11: Kim loại nào trong các kim loại sau không tác dụng với oxi A. Au B. Na C. Cu D. Fe Câu 12: Cho H2SO4 đặc nóng tác dụng với Cu tạo ra chất khí nào trong các chất khí sau: A. SO3 B. SO2 C. H2S D. H2 II. TỰ LUẬN (7 điểm) Câu 1 (1,5đ) Hãy viết các phương trình hóa học biểu diễn dãy chuyển hóa theo sơ đồ sau và ghi rõ điều kiện phản ứng (nếu có) Fe FeCl2 Fe(OH)2 FeO Câu 2 (1,5đ) Cho các oxit có công thức sau : Na2O; SO2; BaO; CuO Phân loại và gọi tên các oxit trên. Câu 3 (2) Nêu phương pháp nhận biết các dung dịch sau và viết các phương trình hoá học của phản ứng xảy ra (nếu có): H2SO4; Na2SO4; BaCl2; NaOH Câu 4 (2đ) Hòa tan 8,8 gam hỗn hợp gồm bột sắt và bột đồng bằng lượng dư dung dịch H2SO4 loãng thu được 2,24 lít khí sinh ra (đktc) và chất rắn X a. Tính % khối lượng các kim loại trong hỗn hợp. b. Hòa tan hoàn toàn chất rắn X bằng H2SO4 đặc, nóng thì thu được bao nhiêu lít khí (đktc)? (Cu = 64; Fe = 56; S = 32 ; H = 1; O = 16) - HÊT- PHÒNG GD&ĐT MANG THÍT TRƯỜNG THCS LONG MỸ (Không kể thời gian phát đề) ĐỀ THI HỌC KỲ I - NĂM HỌC 2016 - 2017 MÔN:HÓA HỌC – KHỐI LỚP 9 Thời gian làm bài : 60 phút ĐỀ B ĐỀ CHÍNH THỨC I. TRẮC NGHIỆM (3 điểm) Hãy khoanh tròn vào câu trả lời đúng: Câu 1. Thí nghiệm bột nhôm tác dụng với oxi được tiến hành bằng cách ACho bột nhôm vào muỗng sắt và đốt trên ngọn lửa đèn cồn B. Cho bột nhôm vào muỗng sắt hơ nóng và đưa vào bình chứa oxi C. Lấy bột nhôm vào mãnh bìa cứng và rắc nhẹ trên ngọn lửa đèn cồn D. lấy thìa sắt xúc bột nhôm đổ lên ngọn lửa đèn cồn Câu 2: Kim loại nào có thể phản ứng được với dung dịch muối đồng sunfat A. Fe B. Ag C. Pb D. Hg Câu 3: Cho H2SO4 đặc nóng tác dụng với Cu tạo ra chất khí nào trong các chất khí sau: A. SO3 B. SO2 C. H2S D. H2 Câu 4. Cặp chất nào sau đây có phản ứng tạo thành sản phẩm là chất khí A. Dung dịch Na2SO4 và dung dịch BaCl2 B. Dung dịch Na2CO3 và dung dịch HCl C. Dung dịch KOH và dung dịch MgCl2 D. Dung dịch KCl và dung dịch AgNO3 Câu 5: Dãy gồm các chất toàn là muối A. NaCl, MgSO4, CuCl2 B. MgSO4, CuCl2, NaOH C. CuCl2, HCl, Na2CO3 D. H2O, NaOH, CuSO4 Câu 6: Kim loại nào trong các kim loại sau không tác dụng với oxi A. Au B. Na C. Cu D. Fe Câu 7. Dãy gồm các kim loại được sắp theo chiều tăng dần về hoạt động hoá học là A. Na ; Al ; Fe ; Cu ; K ; Mg B. Cu ; Fe ; Al ; K ; Na ; Mg C Fe ; Al ; Cu ; Mg ; K ; Na D. Cu ; Fe ; Al ; Mg ; Na ; K. Câu 8 : Dãy gồm các kim loại đều tác dụng với H2SO4 loãng là A. Na ; Cu ; Mg B. Zn ; Mg ; Al C. Na ; Fe ; Cu D. K ; Na ; Ag Câu 9: Khí SO2 phản ứng được với tất cả các chất trong dãy nào sau đây ? A. CaO ; K2SO4 ; Ca(OH)2 B. NaOH ; CaO ; H2O C. Ca(OH)2 ; H2O ; BaCl2 D. NaCl ; H2O ; CaO Câu 10: Dãy gồm các chất toàn là oxit axit là A. CaO, CO2, CO B. CO2, Na2O, MgO C. CO2, SO2, P2O5 D. CaO, P2O5, Na2O Câu 11: Dãy kim loại nào sau đây đều phản ứng với nước ở nhiệt độ thường ? A. Na, Ag B. K, Ca C. Zn, Cu D. Fe, K Câu 12: Thí nghiệm hóa học nào giúp ta hiểu được lý do không nên dùng dụng cụ bằng nhôm để đựng vôi, nước vôi tôi,vữa xây dựng A. Nhôm tác dụng với nước B. Nhôm tác dụng với dung dịch muối C. Nhôm tác dụng với dung dịch kiềm D. Nhôm tác dụng với dung dịch axit II. TỰ LUẬN (7 điểm) Câu 1 (1,5đ) Hãy viết các phương trình hóa học biểu diễn dãy chuyển hóa theo sơ đồ sau và ghi rõ điều kiện phản ứng (nếu có) Fe FeCl2 Fe(OH)2 FeO Câu 2 (1,5đ) Cho các oxit có công thức sau : Na2O; SO2; BaO; CuO Phân loại và gọi tên các oxit trên. Câu 3 (2) Nêu phương pháp nhận biết các dung dịch sau và viết các phương trình hoá học của phản ứng xảy ra (nếu có): H2SO4; Na2SO4; BaCl2; NaOH Câu 4 (2đ) Hòa tan 8,8 gam hỗn hợp gồm bột sắt và bột đồng bằng lượng dư dung dịch H2SO4 loãng thu được 2,24 lít khí sinh ra (đktc) và chất rắn X a. Tính % khối lượng các kim loại trong hỗn hợp. b. Hòa tan hoàn toàn chất rắn X bằng H2SO4 đặc, nóng thì thu được bao nhiêu lít khí (đktc)? (Cu = 64; Fe = 56; S = 32 ; H = 1; O = 16) - HÊT- ĐÁP ÁN VÀ BIỂU ĐIỂM: HÓA 9 I. Trắc nghiệm (3,0 điểm) ĐỀ 1 2 3 4 5 6 7 8 9 10 11 12 A B C B C B D B A C B A B B C B B B B A D B B C A C II. Tự luận (7,0 điểm) Câu 1 : (1,5 điểm) Mỗi phương trình đúng 0.5 điểm 1. Fe + 2HCl FeCl2 + H2 2. FeCl2 + 2NaOH Fe(OH)2 + 2NaCl 3. Fe(OH)2 FeO + H2O Câu 2 : (1,5 điểm) Gọi tên đúng 4 oxit : (0,5 điểm). Phân loại đúng 4 oxit (1 điểm) Câu 3 : (2 điểm) H2SO4; Na2SO4; BaCl2; NaOH - Dùng quỳ tím : H2SO4 làm quỳ tím hóa đỏ 0,5 điểm NaOH làm quỳ tím hóa xanh 0.5 điểm - Dùng H2SO4 : nhận được BaCl2 (xuất hiện kết tủa trắng BaSO4) 0.5 điểm PTPƯ : H2SO4 + BaCl2 BaSO4 ↓ + 2H2O 0.5 điểm Câu 4 : (2 điểm) Số mol H2 = 0,1 mol 0.25 điểm PTPƯ : H2SO4 + Fe FeSO4 + H2 0.25 điểm mFe = 5,6 g => %Fe = 63,6% => %Cu = 36,4% 0.25 điểm PTPƯ : 2H2SO4 đ + Cu CuSO4 + SO2 + 2H2O 0.5 điểm Số mol Cu = 0,05 mol => nSO2 = 0,05 mol 0.5 điểm VSO2 = 1,12 lít 0.25 điểm
Tài liệu đính kèm:
 HÓA 9 (THI).doc
HÓA 9 (THI).doc





