Bài kiểm tra môn: Hóa học 9 lần 1 - Trường THCS Tân Duyệt
Bạn đang xem tài liệu "Bài kiểm tra môn: Hóa học 9 lần 1 - Trường THCS Tân Duyệt", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
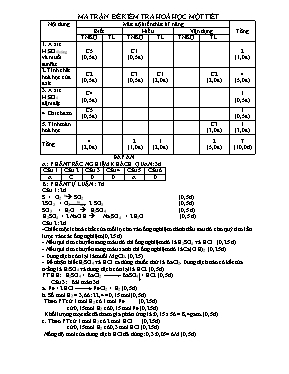
MA TRẬN ĐỀ KIỂM TRA HOÁ HỌC MỘT TIẾT Nội dung Mức độ kiến thức kĩ năng Tổng Biết Hiểu Vận dụng TNKQ TL TNKQ TL TNKQ TL 1. A xit H2SO4loảng và muối sunfat C5 (0,5đ) C1 (0,5đ) 2 (1,0đ) 2.Tính chất hoá học của axít C2 (0,5đ) C3 (0,5đ) C1 (2,0đ) C2 (2,0đ) 4 (5,0đ) 3. A xit H2SO4 đậmđặc C4 (0,5đ) 1 (0,5đ) 4. Oxit bazơ C5 (0,5đ) 1 (0,5đ) 5. Tính toán hoá học C3 (3,0đ) 1 (3,0đ) Tổng 4 (2,0đ) 2 (1,0đ) 1 (2,0đ) 2 (5,0đ) 7 (10,0đ) ĐÁP ÁN A: PHẦN TRẮC NGHIỆM KHÁCH QUAN: 3đ Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 A C D D A D B: PHẦN TỰ LUẬN : 7đ Câu 1: 2đ S + O2 toà SO2 (0,5 đ) 2SO2 + O2 toxt 2 SO3 (0,5 đ) SO3 + H2O à H2SO4 (0,5 đ) H2SO4 + 2 NaOH à Na2SO4 + 2H2O (0,5 đ) Câu 2: 2đ -Chiết một ít hoá chất của mỗi lọ cho vào ống nghiệm đánh dấu sau đó cho quỳ tím lần lược vào các ống nghiệm (0,25 đ) - Nếu quì tím chuyển sang màu đỏ thì ống nghiệm đó là H2SO4 và HCl (0,25 đ) - Nếu quì tím chuyển sang màu xanh thì ống nghiệm đó là Ca(OH)2 (0,25 đ) - Dung dịch còn lại là muối MgCl2. (0,25) - Để nhận biết H2SO4 và HCl ta dùng thuốc thử là BaCl2. Dung dịch nào có kết tủa trắng là H2SO4 và dung dịch còn lại là HCl. (0,5đ) PTHH: H2SO4 + BaCl2 BaSO4 + HCl. (0,5đ) Câu 3: Bài toán 3đ a. Fe + 2HCl FeCl2 + H2 (0,5đ) b. Số mol H2 = 3,66 : 22,4 = 0,15 mol (0,5đ) Theo PT cứ 1 mol H2 có 1 mol Fe (0,25đ) cứ 0,15 mol H2 có 0,15 mol Fe (0,25đ) Khối lượng mạt sắt đã tham gia phản ứng là: 0,15 x 56 = 8,4 gam. (0,5đ) c. Theo PT cứ 1 mol H2 có 2 mol HCl (0,25đ) cứ 0,15 mol H2 có 0,3 mol HCl (0,25đ) Nồng độ mol của dung dịch HCl đã dùng: 0,3:0,05 = 6M (0,5đ) TRƯỜNG THCS TÂN DUYỆT Họ và tên: Lớp: .. BÀI KIỂM TRA Môn: HÓA HỌC 9 LẦN 1 Thời gian: 45 phút Điểm: Lời phê của Giáo viên: A: PHẦN TRẮC NGHIỆM KHÁCH QUAN: (3đ) Chọn câu đúng bằng cách khoanh tròn chữ cái A, B, C hoặc D cho các câu đáp án dưới đây. Câu 1: Dung dịch axit H2SO4 làm quì tím chuyển sang A: Màu đỏ ; B: Màu xanh; C: Màu trắng ; D: Màu vàng Câu 2: Kim loại nào sau đây không tác dụng với axit H2SO4 loãng A : Al; B : Zn; C: Cu; D: Mg Câu 3 : Sản phẩm nào được tạo ra khi cho axit tác dụng với bazơ A: Muối; B: Axit C: Khí H2 D: Muối và nước Câu 4: Những axit nào sau đây tác dụng với kim loại Cu A: HCl B: H3PO4 C: H2SO4 loãng D: H2SO4 đ.nóng Câu 5: Sau khi cho dung dịch H2SO4 vào dung dịch BaCl2 sau khi kết thúc phản ứng chất kết tủa thu được là A: BaSO4 B: Ca(OH)2 C: Ba(NO3)2 D: BaCl2 Câu 6: Na2O tác dụng được với chất nào sau đây A : H2O B : CO2 C: K2O D: A, B B: PHẦN TỰ LUẬN :(7đ) Câu 1:(2,0đ) Thực hiện chuỗi biến hoá sau: S à SO2 àSO3 àH2SO4àNa2SO4 Câu 2: (2đ) Có 4 lọ hoá chất mất nhãn đựng 4 loại hóa chất sau: HCl; MgCl2; Ca(OH)2; H2SO4. Bằng phương pháp hóa học hãy nêu cách nhận biết trên và viết PTPƯ Câu 3 : Bài toán (3,0 đ) Cho một khối lượng mạt sắt dư vào 0,05 lít dung dịch HCl. Phản ứng xong thu được 3,36 lít khí (ở đktc). A. Viết phương trình phản ứng hoá học xãy ra; B. Tính khối lượng mạt sắt đã tham gia phản ứng; C. Tính nồng độ mol của dung dịch HCl đã dùng. TRƯỜNG THCS TÂN DUYỆT Họ và tên: Lớp: .. BÀI KIỂM TRA Môn: HÓA HỌC 9 LẦN 1 Thời gian: 45 phút Điểm: Lời phê của Giáo viên: A: PHẦN TRẮC NGHIỆM KHÁCH QUAN: (3đ) Chọn câu đúng bằng cách khoanh tròn chữ cái A, B, C hoặc D cho các câu đáp án dưới đây. Câu 1: Dung dịch axit H2SO4 làm quì tím chuyển sang A: Màu đỏ ; B: Màu xanh; C: Màu trắng ; D: Màu vàng Câu 2: Kim loại nào sau đây không tác dụng với axit H2SO4 loãng A : Al; B : Zn; C: Cu; D: Mg Câu 3 : Sản phẩm nào được tạo ra khi cho axit tác dụng với bazơ A: Muối; B: Axit C: Khí H2 D: Muối và nước Câu 4: Những axit nào sau đây tác dụng với kim loại Cu A: HCl B: H3PO4 C: H2SO4 loãng D: H2SO4 đ.nóng Câu 5: Sau khi cho dung dịch H2SO4 vào dung dịch BaCl2 sau khi kết thúc phản ứng chất kết tủa thu được là A: BaSO4 B: Ca(OH)2 C: Ba(NO3)2 D: BaCl2 Câu 6: Na2O tác dụng được với chất nào sau đây A : H2O B : CO2 C: K2O D: A, B B: PHẦN TỰ LUẬN :(7đ) Câu 1:(2,0đ) Thực hiện chuỗi biến hoá sau: S à SO2 àH2SO3àNa2SO3 àSO2 Câu 2: (2đ) Có 4 lọ hoá chất mất nhãn đựng 4 loại hóa chất sau: HCl; MgCl2; Ca(OH)2; Na2SO4. Bằng phương pháp hóa học hãy nêu cách nhận biết trên và viết PTPƯ Câu 3 : Bài toán (3,0 đ) Biết 2,24 lít khí CO2(đktc) tác dụng vừa hết 0,2 lít dung dịch Ba(OH)2, sản phẩm là BaCO3 và nước. A. Viết phương trình phản ứng hoá học xãy ra; B. Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng; C. Tính khối lượng chất kết tủa thu được. ĐÁP ÁN ĐỀ 1 A: PHẦN TRẮC NGHIỆM KHÁCH QUAN: 3đ Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 A C D D A D B: PHẦN TỰ LUẬN : 7đ Câu 1: 2đ S + O2 toà SO2 (0,5 đ) 2SO2 + O2 toxt 2 SO3 (0,5 đ) SO3 + H2O à H2SO4 (0,5 đ) H2SO4 + 2 NaOH à Na2SO4 + 2H2O (0,5 đ) Câu 2: 2đ -Chiết một ít hoá chất của mỗi lọ cho vào ống nghiệm đánh dấu sau đó cho quỳ tím lần lược vào các ống nghiệm (0,25 đ) - Nếu quì tím chuyển sang màu đỏ thì ống nghiệm đó là H2SO4 và HCl (0,25 đ) - Nếu quì tím chuyển sang màu xanh thì ống nghiệm đó là Ca(OH)2 (0,25 đ) - Dung dịch còn lại là muối MgCl2. (0,25) - Để nhận biết H2SO4 và HCl ta dùng thuốc thử là BaCl2. Dung dịch nào có kết tủa trắng là H2SO4 và dung dịch còn lại là HCl. (0,5đ) PTHH: H2SO4 + BaCl2 BaSO4 + HCl. (0,5đ) Câu 3: Bài toán 3đ a. Fe + 2HCl FeCl2 + H2 (0,5đ) b. Số mol H2 = 3,66 : 22,4 = 0,15 mol (0,5đ) Theo PT cứ 1 mol H2 có 1 mol Fe (0,25đ) cứ 0,15 mol H2 có 0,15 mol Fe (0,25đ) Khối lượng mạt sắt đã tham gia phản ứng là: 0,15 x 56 = 8,4 gam. (0,5đ) c. Theo PT cứ 1 mol H2 có 2 mol HCl (0,25đ) cứ 0,15 mol H2 có 0,3 mol HCl (0,25đ) Nồng độ mol của dung dịch HCl đã dùng: 0,3:0,05 = 6M (0,5đ) ĐÁP ÁN ĐỀ 2 A: PHẦN TRẮC NGHIỆM KHÁCH QUAN: 3đ Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 A C D D A D B: PHẦN TỰ LUẬN : 7đ Câu 1: 2đ S + O2 toà SO2 (0,5 đ) SO2 + H2O H2 SO3 (0,5 đ) H2SO3 + Na2O Na2SO3 + H2O hoặc H2SO3 + 2NaOH Na2SO3 +2 H2O (0,5 đ) H2SO4 + Na2SO3 Na2SO4+ 2H2O + SO2 (0,5 đ) Câu 2: 2đ -Chiết một ít hoá chất của mỗi lọ cho vào ống nghiệm đánh dấu sau đó cho quỳ tím lần lược vào các ống nghiệm (0,25 đ) - Nếu quì tím chuyển sang màu đỏ thì ống nghiệm đó là HCl (0,25 đ) - Nếu quì tím chuyển sang màu xanh thì ống nghiệm đó là Ca(OH)2 (0,25 đ) - Dung dịch còn lại là muối MgCl2 và Na2SO4. (0,25) - Để nhận biết Na2SO4 và MgCl2 ta dùng thuốc thử là BaCl2. Dung dịch nào có kết tủa trắng là Na2SO4 và dung dịch còn lại là MgCl2. (0,5đ) PTHH: H2SO4 + BaCl2 BaSO4 + HCl. (0,5đ) Câu 3: Bài toán 3đ a. CO2 + Ba(OH)2 BaCO3 + H2O (0,5đ) b. Số mol CO2 = 2,24 : 22,4 = 0,1 mol (0,5đ) Theo PT cứ 1 mol CO2 có 1 mol Ba(OH)2 (0,25đ) cứ 0, 1 mol CO2 có 0,1 mol Ba(OH)2 (0,25đ) Nồng độ mol của dd Ba(OH)2 đã dùng là: 0,1 : 0,2 = 0,5 M. (0,5đ) c. Theo PT cứ 1 mol CO2 có 1 mol BaCO3 (0,25đ) cứ 0,1 mol CO2 có 0,1 mol BaCO3 (0,25đ) Khối lượng chất kết tủa thu được là: 0,1 x 197 = 19,7 gam (0,5đ)
Tài liệu đính kèm:
 de_kiem_tra_hoa_9_lan_1_co_MT_DA.doc
de_kiem_tra_hoa_9_lan_1_co_MT_DA.doc





